Congresso Annuale della World Muscle Society (WMS): aggiornamenti dalle company
Si è appena conclusa la 24° edizione del Congresso Annuale Internazionale della World Muscle Society che si è svolto quest’anno dal 2 al 5 ottobre a Copenhagen, in Danimarca.
Come ogni anno, questo è un evento molto partecipato e importante nel panorama delle malattie neuromuscolari, dove numerose aziende biofarmaceutiche impegnate nel campo presentano tutte le novità e gli aggiornamenti relativi ai propri studi, cui fanno seguito i relativi comunicati stampa.
Riportiamo di seguito una carrellata delle principali novità presentate al congresso con i relativi link ai comunicati stampa.
CATABASIS
Catabasis Pharmaceuticals ha presentato i dati relativi alla fase 2 dello studio MoveDMD con edasalonexent e alla sua estensione in aperto (studio in cui non è presente alcun gruppo di controllo) in ragazzi affetti da distrofia muscolare di Duchenne. Edasalonexent è stata sviluppata come potenziale terapia sostitutiva di quella basata sui corticosteroidi ed è indipendente dal tipo di mutazione.
I dati presentati dimostrano che edasalonexent è in grado di rallentare la progressione della malattia rispetto al periodo di controllo senza il trattamento e che è ben tollerato a lungo termine (oltre 55 anni-paziente cumulativi di esposizione).
I dati sulla sicurezza e la tollerabilità provenienti dallo studio MoveDMD supportano la possibilità che edasalonexent possa diventare una terapia standard per i ragazzi con distrofia muscolare di Duchenne, dal momento della diagnosi in poi. I biomarker indicativi dello stato di salute e dell'infiammazione muscolare sono migliorati significativamente e la maggior parte degli eventi avversi registrati è stata di lieve entità. Edasalonexent non essendo uno steroide, non ha mostrato gli effetti collaterali noti dei corticosteroidi.
Edasalonexent è attualmente in studio nel trial di fase 3 PolarisDMD, i risultati di questo studio, previsti per il quarto trimestre del 2020, saranno determinanti al fine di una possibile richiesta di autorizzazione alla commercializzazione.
Potete leggere il comunicato stampa originale diffuso da Catabasis Pharmaceuticals al seguente link
PTC
PTC Therapeutics ha presentato i nuovi dati sulla funzionalità polmonare provenienti dal registro internazionale per i pazienti con distrofia muscolare di Duchenne causata da una mutazione nonsenso in trattamento con Translarna™ (ataluren) - STRIDE (Strategic Targeting of Registries and International Database of Excellence). Il registro STRIDE è uno strumento post-approvazione multicentrico e osservazionale dei pazienti che stanno ricevendo Translarna™ che mira a fornire informazioni sulla sicurezza e l’efficacia di ataluren come terapia a lungo termine.
I dati raccolti dimostrano che i bambini e gli adolescenti in trattamento con Translarna™ conservano la funzionalità polmonare rispetto a un gruppo abbinato in uno studio di storia naturale a lungo termine. I dati presentati sono stati diffusi anche attraverso un comunicato stampa diffuso il 4 ottobre.
Potete leggere la traduzione del comunicato stampa diffuso da PTC al seguente link.
CAPRICOR
L’azienda statunitense Capricor Therapeutics ha presentato i risultati positivi di alcune analisi intermedie condotte a 6 mesi su 20 partecipanti allo studio HOPE-2, il trial clinico di fase 2 con CAP-1002 in corso negli Stati Uniti che coinvolge pazienti DMD anche non deambulanti.
La strategia si basa sulla somministrazione di cellule staminali cardiache derivate da tessuto cardiaco proveniente da donatori, ma non è una vera e propria terapia cellulare. Le cellule infatti non si integrano né ripopolano il cuore del ricevente, ma agiscono liberando fattori specifici che intervengono sull’infiammazione, la fibrosi e la rigenerazione cardiaca e che sembrano avere un impatto anche sulla funzionalità muscolare e polmonare.
I dati presentati nel convegno e descritti nel comunicato emesso il 7 ottobre, si riferiscono principalmente alle valutazioni condotte dopo 6 mesi dall’inizio del trattamento mediante la scala PUL 2.0 - Performance of the Upper Limb function - un test che misura la funzionalità dell’arto superiore analizzata considerando tre livelli: partendo dalla spalla, dal gomito e dal polso. Il confronto dei punteggi registrati nel gruppo che ha ricevuto la terapia rispetto a quelli ottenuti nel gruppo placebo, evidenzia risultati migliori nei pazienti trattati con CAP-1002 in ciascuno dei livelli indagati, un dato in linea con i risultati annunciati qualche mese fa e che si riferivano all’analisi del solo livello intermedio della stessa scala.
L’azienda prevede un nuovo incontro con l’Agenzia statunitense dei medicinali, FDA, per proseguire il confronto sullo sviluppo della strategia. Nuovi aggiornamenti sullo studio sono attesi entro la fine del 2019.
Questo il link al comunicato originale
REVERAGEN
L’azienda biofarmaceutica ReveraGen, ha presentato i dati relativi ai pazienti con distrofia muscolare di Duchenne in trattamento con vamorolone nel trial VBP15-LTE. La notizia è stata riportata in un comunicato diffuso il 5 ottobre dalla stessa ReveraGen e in un secondo comunicato diffuso il 7 ottobre da Santhera che, come annunciato lo scorso novembre (al seguente link la notizia), ha acquisito il diritto di licenza esclusiva per vamorolone.
Vamorolone è un farmaco anti infiammatorio sviluppato da ReveraGen come sostituto del cortisone nel trattamento per la distrofia muscolare di Duchenne.
I dati presentati sono relativi ad almeno 18 mesi di trattamento di 23 dei 45 ragazzi che, dopo aver concluso il trial VBP-15 della durata di 6 mesi, sono entrati in uno studio di estensione della durata di 2 anni con dosi aumentate del farmaco.
I risultati sono incoraggianti: il trattamento con vamorolone ha portato ad un miglioramento persistente della funzionalità motoria, mostrando al tempo stesso una migliore tollerabilità al farmaco rispetto al trattamento con corticosteroidi, come evidenziato dai dati di storia naturale relativi ad un gruppo di controllo esterno.
Vamorolone ha ottenuto la designazione di Farmaco Orfano negli Stati Uniti e in Europa e la designazione Fast Track dalla FDA. Viene definito Farmaco Orfano un medicinale in via di sviluppo per una malattia rara e molto grave, mentre Fast Track è una designazione che mira ad accelerare le fasi di revisione durante il processo che porta all’approvazione di un farmaco.
Di seguito i link ai due comunicati stampa originali di ReveraGen e di Santhera.
NIPPON SHINYAKU
Viltolarsen è un oligonucleotide antisenso (AON) sviluppato dall’azienda giapponese Nippon Shinyaku per indurre lo skipping dell’esone 53 del gene della distrofina. Sono tre i comunicati stampa, diffusi tra il 2 e il 7 ottobre 2019, che riassumono le principali novità dall’azienda nipponica
Nel comunicato del 2 ottobre l’azienda ha annunciato di avere completato la richiesta per la presentazione di New Drug Application (NDA) alla FDA statunitense per viltolarsen. La NDA è la Domanda per i Nuovi Farmaci che viene di norma presentata alla FDA per la richiesta di autorizzazione alla commercializzazione di un farmaco o terapia negli Stati Uniti.
Nei comunicati del 7 ottobre, la biotech riassume i risultati dei due studi clinici rispettivamente di fase 1/2 (in Giappone) e di fase 2 (negli Stati Uniti) presentati durante il Congresso della WMS:
- il primo studio di fase 1/2 si è svolto in Giappone su 16 bambini di età compresa tra i 5 e i 12 anni. Sebbene il numero di pazienti fosse limitato, una tendenza all'aumento della forza muscolare come endpoint secondario è stata osservata dopo il trattamento nel gruppo trattato con 80 mg/kg
- il secondo studio clinico di fase 2 si è svolto in Nord America su 16 bambini tra i 4 e 9 anni deambulanti. Lo studio era suddiviso in due fasi: la prima in doppio cieco, controllata con placebo, ha avuto una durata di 4 settimane, durante le quali 5 pazienti hanno ricevuto il placebo. Nella seconda fase, della durata di 20-24 settimane, tutti i partecipanti hanno ricevuto viltolarsen al dosaggio di 40 mg/kg o 80 mg/kg a settimana. Tutti i partecipanti a questo trial sono stati inclusi in uno studio di estensione in aperto fino a 144 settimane di trattamento. I risultati dopo 24 settimane, insieme ai dati provvisori dello studio di estensione in aperto in cui il trattamento è stato prolungato a 73 settimane, possono supportare l'ulteriore sviluppo di viltolarsen.
Di seguito il comunicato del 2 ottobre e i due comunicati del 7 ottobre relativi allo studio in Giappone e allo studio negli Stati Uniti.
A cura dell’Ufficio Scientifico di Parent Project aps
Per ulteriori informazioni su CAP-1002, edasalonexent, ataluren, vamorolone e viltolarsen potete consultare la Brochure dei trial clinici di Parent Project aps.
Exon skipping: utilizzare un cocktail di molecole antisenso per colpire più esoni
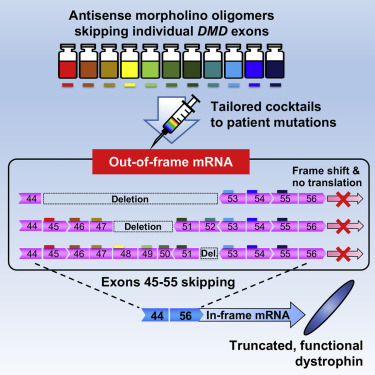
Uno studio pubblicato sulla rivista scientifica Molecular Therapy descrive l’utilizzo di una miscela di oligonucleotidi antisenso per effettuare lo skipping degli esoni che vanno dal 45 al 55. Una strategia che, potenzialmente, permetterebbe di trattare quasi la metà della popolazione Duchenne. La ricerca è in fase preclinica, le molecole sono state testate sia in cellule che in topi modello per la DMD.
Come noto, la strategia di exon skipping è un approccio ideato per ‘correggere’ mutazioni genetiche, per la maggior parte delezioni, che causano un cambiamento nello schema di lettura del gene della distrofina e la mancata produzione della proteina funzionale. Il corretto schema di lettura può essere ristabilito utilizzando piccole molecole antisenso (oligonuclotidi antisenso - AON) che causano l’eliminazione di specifici esoni. La distrofina prodotta sarà più corta del normale ma potrà ancora svolgere la sua funzione muscolare. Le strategie attuali in via di sviluppo clinico per la Duchenne si basano sull’utilizzo di un unico AON che mira a far ‘saltare’ un singolo esone e quindi in grado di ‘correggere’ solo un numero limitato di mutazioni.
Nel 2016, Eteplirsen è stato approvato negli Stati Uniti - dal FDA - come primo farmaco a base di AON per la DMD. Si tratta di una molecola antisenso di tipo morfolino fosforodiamidato (PMO) sviluppata per il trattamento dei pazienti Duchenne che hanno una delezione nel gene della distrofina potenzialmente trattabile con lo skipping dell’esone 51. Tali pazienti rappresentano circa il 13% della popolazione Duchenne. Altre molecole antisenso di tipo PMO che mirano ad altri esoni (come ad esempio il 45 o il 53) sono attualmente in sperimentazione clinica a livello internazionale. L’exon skipping rappresenta una strategia terapeutica promettente per la comunità Duchenne ma il fatto che miri ad un singolo esone alla volta, e quindi ad una ristretta percentuale di popolazione DMD, è un fattore limitante.
Per superare questo aspetto, un team internazionale di ricercatori (Canada, Giappone, Francia e Gran Bretagna) ha puntato a una strategia di multiexon skipping utilizzando un cocktail di diverse molecole di tipo PMO per eliminare in un colpo solo il blocco di esoni 45-55. Lo studio è stato pubblicato lo scorso luglio sulla rivista scientifica Molecular Therapy . L’obiettivo di questa strategia è la produzione di una variante della distrofina che pur essendo più corta mantiene la sua funzionalità e che è nota per essere presente in diversi pazienti che hanno un quadro clinico eccezionalmente attenuato. Rappresenterebbe inoltre un potenziale trattamento per più della metà della popolazione Duchenne (fino al 65%) che includerebbe non solo i pazienti che hanno delezioni ma anche quelli con duplicazioni e mutazioni puntiformi in questa regione del gene.
I ricercatori hanno utilizzato strumenti predittivi per disegnare e selezionare le molecole antisenso sulla base della loro efficienza di skipping e creare così i cocktail da testare. Gli esperimenti sono stati condotti su cellule muscolari prelevate da pazienti Duchenne e su topi modello per la patologia nei quali è stato inserito il gene umano della DMD. Il cocktail più efficace è stato in grado di eliminare tutti e gli 11 esoni, ovvero l’intero blocco di esoni 45-55, e di ripristinare la produzione della distrofina nella sua forma accorciata e, teoricamente, funzionale.
È importante sottolineare che la ricerca è ancora in fase preclinica. Come riportato sulla pubblicazione dagli autori stessi, prima di poter parlare di applicazione clinica sui pazienti sono necessari ulteriori studi per approfondire non solo l’efficacia di questa strategia ma anche la sua sicurezza in animali modello. Un percorso che è ancora al suo inizio.
A cura dell’Ufficio Scientifico di Parent Project aps
Dal 7 al 13 ottobre 2019 torna la Settimana delle Sezioni UILDM.
Segnaliamo con piacere l'iniziativa di Uildm
“Con noi conti di più”: l’impegno che unisce le persone
Dal 7 al 13 ottobre 2019 torna la Settimana delle Sezioni UILDM. L’impegno delle 65 Sezioni UILDM e le storie dei volontari , con e senza disabilità, saranno al centro dell’evento organizzato dall’Unione Italiana Lotta alla Distrofia Muscolare

Padova, xx settembre 2019 – Torna anche quest’anno dal 7 al 13 ottobre la Settimana delle Sezioni UILDM. Sette giorni interamente dedicati alle 65 Sezioni locali di UILDM – Unione Italiana Lotta alla Distrofia Muscolare presenti in Italia, l’occasione per conoscere più da vicino l’importante attività quotidiana che svolgono in favore delle persone con distrofia muscolare.
Al centro della Settimana ci saranno le storie dei volontari UILDM che offrono il loro tempo per migliorare la vita delle persone con disabilità e per rendere concreta l’inclusione nelle comunità in cui viviamo, nelle scuole, nei posti di lavoro e in tutti i luoghi che frequentiamo ogni giorno.
Grazie all’energia dei volontari, UILDM sta mettendo in atto importanti progetti per il diritto al gioco dei bambini con disabilità con “Giocando si impara”, di sensibilizzazione con “A scuola di inclusione” e di inclusione lavorativa con “PLUS: per un lavoro utile e sociale”. Si tratta di azioni concrete, servizi che migliorano la qualità della vita di chi ha una malattia neuromuscolare.
Grazie ai volontari, le Sezioni UILDM facilitano l’inclusione tramite i progetti di Servizio Civile, l’organizzazione di vacanze accessibili, lavorano per l’accessibilità e l’abbattimento delle barriere architettoniche. Il 42% delle Sezioni UILDM offre servizi in ambito medico-riabilitativo, il 95% offre servizi di consulenza e Segretariato sociale e si occupa del trasporto delle persone con disabilità; in totale le Sezioni in un anno offrono oltre 4.500 consulenze e percorrono più di 640.000 Km.
«Ad accompagnarci quest’anno lo slogan: “Con noi conti di più”. Per noi di UILDM ogni volontario non è un numero, ma una persona con una propria storia, che vale la pena di essere raccontata. In UILDM ne abbiamo tante da raccontare: sono quelle dei nostri 3.000 volontari con e senza disabilità. Sono loro la nostra forza, le braccia e le gambe che ci hanno accompagnato in questi 58 anni di vita», dichiara Marco Rasconi, presidente nazionale UILDM.
Durante la Settimana, le Sezioni UILDM presenti sul territorio italiano apriranno le porte delle loro sedi e organizzeranno eventi per far conoscere e raccontare il valore del dono del proprio tempo. Essere un volontario UILDM significa infatti poter contribuire in maniera personale a far crescere l’associazione e la comunità di riferimento, facendo sentire ciascuna persona unica per la storia che porta con sé.
Il volontariato è una forza capace di unire persone diverse per esperienza e provenienza, dando valore al contributo del singolo. Secondo i dati Istat del 2013, circa un italiano su otto svolge attività gratuite per gli altri e per la comunità. In Italia il numero di volontari è stimato in 6,63 milioni di persone, (tasso di volontariato totale pari al 12,6%). Sono 4,14 milioni i cittadini che svolgono la loro attività in un gruppo o in un'organizzazione (tasso di volontariato organizzato pari al 7,9%) mentre i restanti si impegnano in maniera non organizzata (tasso di volontariato individuale pari al 5,8%).
Trovi tutte le novità e gli eventi delle Sezioni legati alla Settimana su uildm.org, Facebook, Twitter, Instagram, LinkedIn e sul nostro canale Youtube.
UILDM – Unione Italiana Lotta alla Distrofia Muscolare nasce nel 1961 con l’obiettivo di promuovere l'inclusione sociale delle persone con disabilità, attraverso l'abbattimento di ogni tipo di barriera, e sostenere la ricerca scientifica e l'informazione sulle distrofie e le altre malattie neuromuscolari. Ha una presenza capillare sul territorio grazie alle 65 Sezioni locali, i 3.000 volontari e i 10.000 soci, che sono punto di riferimento per circa 30.000 persone. UILDM svolge un importante lavoro in ambito sociale e di assistenza medico-riabilitativa ad ampio raggio, gestendo anche centri ambulatoriali di riabilitazione, prevenzione e ricerca, in stretta collaborazione con le strutture universitarie e socio-sanitarie.
Catabasis annuncia il completamento del reclutamento nel trial PolarisDMD di fase 3 con edasalonexent per la distrofia muscolare di Duchenne
In un comunicato stampa diffuso il 30 settembre 2019, l’azienda biofarmaceutica Catabasis ha annunciato il completamento della fase di reclutamento nel trial di fase 3 PolarisDMD con edasalonexent, per il trattamento della DMD.
Edasalonexent è una piccola molecola ad uso orale che agisce come inibitore di NF-kB, una proteina chiave nel processo infiammatorio che è attivata in maniera cronica quando la distrofina è assente. La molecola è stata sviluppata come potenziale terapia sostitutiva di quella basata sui corticosteroidi ed è indipendente dal tipo di mutazione.
L’interesse per questo trial da parte delle famiglie e dei centri clinici coinvolti nello studio è stato tale che il reclutamento è andato oltre le aspettative e ha incluso 5 ragazzi in più rispetto all’atteso, per un totale di 130 ragazzi reclutati.
I risultati del trial verranno diffusi durante l’ultimo trimestre dell’anno corrente, con l’auspicio da parte dell’azienda di poter sottomettere alla FDA una richiesta finalizzata all'immissione in commercio del trattamento nel 2021.
Il trial, attualmente in corso in 40 siti in 8 paesi, al momento non include l'Italia.
Tutti i ragazzi che avranno completato le 52 settimane di trattamento potranno entrare in uno studio di estensione in cui tutti i partecipanti riceveranno il trattamento. Questo studio, denominato GalaxyDMD, valuterà la sicurezza e l'efficacia del farmaco a lungo termine.
A cura dell’Ufficio Scientifico di Parent Project aps
Potete leggere la traduzione del comunicato stampa diffuso da Catabasis al seguente link, e il comunicato stampa originale al seguente link
Per ulteriori informazioni su edasalonexent, potete consultare la Brochure dei Trial Clinici di Parent Project.
Un Natale Goloso ed...esclusivo con Parent Project!
Sta per iniziare l'autunno e, come ogni anno, il lungo periodo che precede il Natale rappresenta, per l'associazione, un momento molto significativo di attività, raccolta fondi e visibilità, in particolare attraverso la campagna "Il Natale Goloso di Parent Project", oltre che per i numerosi eventi locali che coloreranno il calendario della nostra comunità!
Proprio i colori saranno protagonisti del Natale Goloso: al fianco dei folletti che ci hanno accompagnato negli ultimi anni, ecco una speciale tiratura di confezioni in edizione limitata, nuove di zecca dalla grafica fresca, festosa ed accattivante.
Come lo scorso anno saranno a disposizione i classici prodotti natalizi - pandoro, panettone classico - ma anche il gustoso panettone al cioccolato e le sfiziose “Delizie di Parent Project": una carrellata di dolcezza per tutti i gusti.
Le confezioni in edizione limitata (disponibili per i panettoni classici e al cioccolato, i pandori e i torroni) andranno prenotate entro e non oltre il 5 novembre. Successivamente, i prodotti saranno comunque disponibili nelle classiche confezioni con i folletti natalizi Parent Project; le ordinazioni verranno raccolte entro il 30 novembre.
Per chi desidera legare ai propri auguri un gesto di solidarietà, sono disponibili i biglietti augurali, anche questi rinnovati con l'introduzione delle nuove grafiche.
Catalogo "Il Natale Goloso di Parent Project"
Modulo d'ordine "Il Natale Goloso di Parent Project"
Catalogo "Biglietti Augurali di Parent Project"
Modulo d'ordine "Biglietti Augurali di Parent Project"
Nel 2018 la campagna natalizia, grazie allo straordinario impegno della nostra comunità, ha permesso di raccogliere 275.289 euro: un grande risultato che potrà ancora crescere!
In tutta Italia centinaia di persone stanno già iniziando ad attivarsi per questa grande maratona di golosità solidale: partecipare è facile, e la tua scelta servirà a mettere sotto l'albero un pezzetto di futuro. Dando forza alla ricerca scientifica e all'impegno quotidiano della nostra comunità per migliorare la qualità della vita dei giovani e giovanissimi pazienti.
Per dare più forza a tutto questo, ci sei tu.
Per ottenere maggiori informazioni e prenotare i prodotti è possibile scrivere all'email segreteria@parentproject.it oppure telefonare al numero 06/66182811.
Introdotti alcuni cambiamenti nella valutazione dell’eleggibilità per lo studio Epidys
Sono state recentemente introdotte da Italfarmaco alcune importanti modifiche nel protocollo dello studio Epidys, il trial di fase 3 con l’inibitore delle istone deacetilasi, givinostat, nella distrofia muscolare di Duchenne. Le modifiche apportate riguardano le valutazioni condotte nella fase di screening dei pazienti in cui si stabilisce la possibile inclusione nel trial.
Di questo studio in corso a livello globale, si è parlato anche durante la Conferenza di Parent Project Muscular Dystrophy (PPMD), tenutasi a Orlando dal 27 al 29 giugno, nell’ambito della sessione sull’infiammazione e la fibrosi, dove Paolo Bettica, Vice Presidente Ricerca e Sviluppo di Italfarmaco, ha illustrato i principali aggiornamenti sul trial.
Lo studio, randomizzato e controllato con placebo, mira a dimostrare la capacità di givinostat di preservare la massa muscolare e rallentare la progressione della patologia e prevede la partecipazione di 242 pazienti Duchenne deambulanti, di età compresa tra i 6 e i 17 anni e in trattamento stabile con steroidi.
A oggi nel trial sono stati inclusi più di 100 pazienti reclutati anche in base alla rispondenza ai risultati di un complesso algoritmo di calcolo usato per stimare la frazione potenziale di tessuto adiposo presente nei muscoli a partire dai risultati di più test funzionali.
Il cambiamento principale introdotto nel disegno dello studio riguarda proprio l’impiego dell’algoritmo che, d’ora in avanti, non sarà più utilizzato per valutare l’eleggibilità. Per quanto riguarda la risonanza magnetica, precedentemente usata nei casi in cui era necessaria una conferma dei risultati dall’algoritmo, la valutazione resterà tra quelle condotte durante il trial ma non sarà più utilizzata in fase di screening. Resteranno invece determinanti per stabilire l’inclusione nello studio i risultati di più test alcuni dei quali modificati nei loro valori limite. In particolare il tempo limite entro il quale alzarsi da terra, precedentemente fissato inferiore ai 10 secondi, dovrà ora essere tra 3 e 10 secondi e sarà permesso un range più ampio della frazione di tessuto adiposo.
I cambiamenti introdotti sono importanti soprattutto per quei pazienti che pur volendo partecipare allo studio, non hanno superato positivamente la fase di screening. Questi pazienti, infatti, se ancora in possesso delle caratteristiche base necessarie per accedere al trial (età, assunzione steroidi, deambulazione), potrebbero richiedere una nuova valutazione e verificare se risultano arruolabili in base ai cambiamenti introdotti.
Un’altra novità in merito allo studio Epidys va inoltre segnalata per quanto riguarda i centri clinici italiani coinvolti nel trial, si è aggiunto infatti il Centro NeMo dell’Ospedale Niguarda di Milano alle 6 strutture già impegnate nello svolgimento dello studio.
Parallelamente agli studi clinici nella Duchenne, Italfarmaco sta conducendo un trial clinico con givinostat anche nei pazienti Becker. Lo studio, tra i pochi in corso in questa popolazione di pazienti, mira a valutare la sicurezza e l’efficacia di givinostat in pazienti Becker deambulanti di età superiore ai 18 anni. L’arruolamento per lo studio, in corso in Italia presso l’Ospedale Maggiore Policlinico di Milano, dovrebbe terminare a fine ottobre, c’è quindi ancora poco più di un mese di tempo per valutare un’eventuale partecipazione.
A cura dell’Ufficio Scientifico di Parent Project aps
Per ulteriori informazioni su givinostat, potete consultare la Brochure dei Trial Clinici al seguente link
Translarna: accesso in Italia anche per i pazienti Duchenne tra i 2 e i 5 anni con mutazione nonsenso deambulanti
Ci sono buone notizie sul fronte dell’accesso a Translarna, il farmaco sviluppato da PTC Therapeutics per il trattamento della distrofia muscolare di Duchenne causata da mutazione nonsenso (nmDMD) già disponibile in Italia per i pazienti deambulanti dai 5 anni di età.
L’Agenzia Italiana del Farmaco (AIFA) ha accolto la richiesta dell'azienda di attivare un programma di uso compassionevole (https://www.aifa.gov.it/farmaci-a-uso-compassionevole) che permetterà anche ai pazienti nmDMD deambulanti tra i 2 e i 5 anni di accedere al trattamento.
L’ampliamento dell’indicazione per Translarna, includendo anche la popolazione dei più piccoli, era stata approvata a settembre dello scorso anno dalla Commissione Europea (https://www.parentproject.it/estesa-lindicazione-di-translarna-ai-bambini-dmd-dai-2-anni-di-eta/) ma l’accesso concreto ai piccoli pazienti in Italia non era, fino ad ora, ancora possibile.
“L'avvio di un programma di uso compassionevole che consenta ai bambini più piccoli di accedere a Translarna è sicuramente una notizia che apprendiamo con grande favore e positività”, dichiara Stefano Mazzariol, Vice Presidente di Parent Project aps. “Ci aspettiamo comunque che questo sia solo un primo passo verso l'estensione definitiva dell'approvazione, dopo il via libera della Commissione Europea.
Da tempo come associazione siamo impegnati sul fronte della diagnosi, che sia quanto più precoce possibile, ed è fondamentale che dopo una diagnosi tempestiva sia garantito altrettanto precocemente il percorso terapeutico per quei bambini e quei ragazzi che possono beneficiarne."
Con l’apertura di questo programma, i clinici di riferimento potranno ora richiedere l’erogazione di Translarna per i loro pazienti avviando il trattamento ad un’età in cui aumenta la possibilità di contrastare al meglio la progressione della patologia e rallentarne il decorso.
A cura dell’Ufficio Scientifico di Parent Project aps
Presentazione del progetto Hostability
Il prossimo 4 ottobre, alle ore 10.00, presso l’Università di Tor Vergata, Facoltà di Ingegneria, si terrà la presentazione ufficiale di Hostability, il progetto della Cooperativa aCapo dedicato al turismo accessibile e all’inclusione sociale.
Il progetto è finanziato dalla Regione Lazio - Assessorato Politiche Sociali, Sport e Sicurezza - Direzione Regionale Salute e Politiche sociali – nell’ambito dell’Avviso Pubblico "Presa in carico, orientamento e accompagnamento per l'inclusione sociale attiva" POR FSE 2014-2020.
Il Progetto:
Hostability specializzerà nella gestione di appartamenti accessibili 18 giovani disabili disoccupati tra i 18 e i 35 anni residenti nel territorio della Regione. I destinatari del progetto daranno vita - al termine dei 10 mesi di specializzazione - al primo circuito di appartamenti accessibili del nostro territorio, generando una offerta di valore inedita all’interno di un percorso di auto occupazione e inserimento sociale.
In occasione dell’evento di lancio saranno presentate le modalità di avvio e di sviluppo del progetto.
Per partecipare all’evento:
Università degli Studi di Tor Vergata
Macroarea di Ingegneria
Aula Convegni
Edificio Didattica, piano terra
Via del Politecnico, 1 – 00133 ROMA
Info:
Segreteria Hostability, Gianmichele Simoni n. cell 3282175692 - hostability@acapo.it
Presentato il nuovo "Progetto Centro Clinico NeMO Ancona"
Si è svolta lunedì 16 settembre, presso l'Auditorium "Sandro Totti" - A.O.U. Ospedali Riuniti di Ancona, la conferenza stampa di presentazione del "Progetto Centro Clinico NeMO Ancona".
Il progetto, frutto della collaborazione tra la Regione Marche, l'Azienda Ospedaliero Universitaria Ospedali Riuniti di Ancona e il Centro Clinico NeMO, realtà nazionale ad alta specializzazione per il trattamento delle malattie neuromuscolari presente oggi a Milano, Arenzano, Messina e Roma, si occuperà della presa in carico globale delle persone con queste patologie, con l'obiettivo di migliorarne la qualità della vita.
Le associazioni dei pazienti coinvolte nel promuovere la presenza di un nuovo Centro Nemo sono: Fondazione Dr.
Dante Paladini Onlus, Uildm e le sue sezioni di Ancona e Pesaro, Aisla Onlus, Associazione Famiglie Sma-Genitori per
l'accoglienza Onlus, Parent Project, Cidp Italia Onlus e Collagene VI Italia Onlus.
Il Centro Clinico NeMO (NeuroMuscular Omnicentre) è un centro clinico ad alta specializzazione, pensato per rispondere in modo specifico alle necessità di chi è affetto da malattie neuromuscolari come la Sclerosi Laterale Amiotrofica (SLA), le distrofie muscolari e l’Atrofia Muscolare Spinale (SMA). Si tratta di patologie altamente invalidanti con un grave impatto sociale, caratterizzate da lunghi e complessi percorsi di cura e assistenziali, per le quali, purtroppo, al momento non c’è possibilità di guarigione.
La sottoscrizione della convenzione tra l'A.O.U. Ospedali Riuniti di Ancona e Fondazione Serena Onlus, ente gestore del Centro Clinico NeMO, per le sedi di Milano, Arenzano e Roma, darà il via alla realizzazione del Centro NeMO Ancona, con l'obiettivo di rispondere in modo efficiente ed efficace al bisogno di cura della comunità dei pazienti del territorio. L'avvio del progetto è un traguardo importante per la comunità dei pazienti marchigiani e della costa adriatica.
Il Centro Clinico NeMO Ancona si prenderà cura di pazienti adulti ed in età pediatrica, mettendo in campo un team multiprofessionale per una presa in carico globale dei bisogni di cura della persona con malattia neuromuscolare e della sua famiglia, che abbia continuità dal punto di vista clinico, assistenziale, terapeutico e riabilitativo. La struttura prevede 12 posti letto per il ricovero ordinario, 2 posti letto per il day hospital e i servizi ambulatoriali.