Progetto teleriabilitazione: il calendario di maggio
Prosegue il progetto dedicato alla fisioterapia online, realizzato grazie al supporto di Cleverage e PTC Therapeutics. Tramite il progetto è possibile usufruire di consulti fisioterapici a distanza a supporto dei programmi riabilitativi prescritti, intesi come assistenza alla famiglia o al caregiver durante lo svolgimento degli esercizi domiciliari oppure come momento di confronto specifico per ogni famiglia, a seconda delle proprie esigenze.
E’ disponibile il calendario delle sedute di teleriabilitazione relativo al mese di maggio (fasce orarie h 17-18 e h 18-19):
- DMD 0-5 anni: Martedì 3/05 - Venerdì 6/05
- DMD 5-10 anni: Lunedì 9/05 - Martedì 10/05 - Venerdì 13/05
- DMD 10-15 anni: Lunedì 16/05 - Martedì 17/05 - Venerdì 20/05
- DMD >15 anni: Lunedì 23/05 - Martedì 24/05 - Venerdì 27/05
Per partecipare ai teleconsulti sarà necessario iscriversi contattando Cristina Bella, fisioterapista Parent Project, via mail all’indirizzo c.bella@parentproject.it oppure tramite Whatsapp al numero 340 154 0979, specificando nome, cognome, età di vostro figlio, indirizzo mail per l’iscrizione su Zoom e numero di telefono su cui essere contattati. Vi verranno forniti maggiori dettagli sullo svolgimento del progetto e il calendario specifico per la vostra fascia d’età per poter scegliere la data più comoda a voi tra quelle disponibili.
Scarica il dépliant del progetto:
L’importanza della caratterizzazione fenotipica nella distrofia muscolare di Becker nella scelta di misure di esito per il monitoraggio dell’evoluzione di malattia, sia nella pratica clinica che nell’ambito di sperimentazioni cliniche - Report Finale
Finanziato da Parent Project aps, il progetto coordinato da Gabriele Siciliano è uno dei tre che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento detta Grant Application, per l’importo di 60.000€. Il progetto è iniziato ad aprile del 2019 e ha avuto una durata di diciotto mesi. Il team di ricerca ha sviluppato un protocollo clinico e molecolare per caratterizzare la variabilità fenotipica dei pazienti con distrofia muscolare di Becker (BMD) attraverso dettagliate valutazioni motorie, cardiologiche e genetiche
La distrofia muscolare di Becker (BMD) pur rappresentando, rispetto alla distrofia muscolare di Duchenne, una forma più lieve e a progressione più lenta, è caratterizzata da una ampia variabilità clinica e può essere responsabile di un carico significativo in termini di disabilità per i pazienti. È fondamentale caratterizzare in modo preciso le modalità di presentazione, gli aspetti clinici e la storia naturale della patologia, in modo da identificare i parametri più adeguati da considerare nella valutazione dell’efficacia di un trattamento.
Questo progetto nasce dalla collaborazione della nostra Unità di Neurologia con la Neuropsichiatria infantile Stella Maris e i colleghi cardiologi del CNR di Pisa ed è finalizzato alla definizione di un protocollo di valutazione multiparametrica per la stratificazione fenotipica dei pazienti e l’identificazione dei fattori di progressione della patologia. I ricercatori al momento hanno valutato 32 pazienti adulti con BMD, seguiti presso il centro pisano; il grado di compromissione funzionale motoria è stata misurata attraverso una serie di scale cliniche già validate; i pazienti hanno inoltre effettuato uno studio del coinvolgimento muscolare con risonanza magnetica muscolare degli arti inferiori. Per un sottogruppo di questi pazienti le valutazioni motorie sono state ripetute dopo un periodo di 24 mesi, così come la risonanza magnetica muscolare. Gli altri elementi considerati erano la mutazione genetica, l’età di esordio dei sintomi, la capacità di camminare, l’eventuale età alla perdita della deambulazione e l’interessamento cardiologico. Il protocollo di valutazione cardiologica ha previsto le seguenti indagini: ECG standard, ECG Holter 24 ore, ecocardiogramma transtoracico, RMN cardiaca con gadolinio, test cardiopolmonare, studio dell’ergoriflesso, chemoriflesso e baroriflesso.
I parametri funzionali motori con cui sono stati valutati i pazienti includono scale funzionali come la North Star Ambulatory Assessment (NSAA), il tempo di salita e discesa di quattro gradini, il 6-minute Walk Test (6MWT), la Walton and Gardner-Medwin Scale e il Manual Force Measurement (MRC scale). I dati clinici di tutti i partecipanti, i risultati dei test motori e le loro RM muscolari sono stati inoltre inseriti sulla piattaforma informatica InGene2.0, attualmente in fase di sviluppo e perfezionamento, sviluppata da un team costituito da medici, bioingegneri e informatici. La piattaforma rappresenta uno strumento di registrazione e analisi multimodale e multiparametrica di dati di varia natura (clinici, genetici, RM, biopsia muscolare) di pazienti affetti da patologie neuromuscolari rare, con lo scopo di supportare la fase diagnostica, il follow-up e l’identificazione di parametri di efficacia di interventi di ogni tipo, fra cui quelli terapeutici.
Le valutazioni iniziali dei pazienti confermano l’importante variabilità che esiste nella severità e nella progressione delle manifestazioni della BMD, in parte correlata alle diverse mutazioni genetiche sul gene della distrofina. Complessivamente le valutazioni ripetute dopo 24 mesi non hanno evidenziato un peggioramento significativo, che è presente solo nei pazienti nei quali è stata riscontrata una delezione del gene della distrofina che coinvolge l’esone 45.
Questi risultati suggeriscono che in alcuni casi i test funzionali motori potrebbero non rappresentare la scelta ottimale per identificare variazioni nella progressione della patologia. Anche l’analisi delle RM muscolari non mostra una progressione significativa nell’arco di due anni, pur con un certo grado di variabilità a seconda del tipo di mutazione. I parametri cardiologici raccolti con il protocollo suddetto sono ancora in fase di valutazione e rielaborazione.
Nel complesso, i dati ottenuti sottolineano l’importanza di definire precisamente le diversità cliniche fra pazienti con BMD e la necessità di stratificazione in gruppi omogenei, per definire la progressione della patologia e scegliere i parametri più sensibili nel monitorarne l’evoluzione, sia nella pratica clinica che in vista di sperimentazioni cliniche.
Giulia Ricci1, Alessandra Govoni1, 4, Francesca Torri1, Guja Astrea2, Bianca Buchignani2, Vincenzo Castiglione3, Alberto Giannoni3, Michele Emdin3, Gabriele Siciliano1
1Neurologia, Dipartimento di Medicina Clinica e Sperimentale, Università di Pisa, Pisa
2Neuropsichiatria Infantile IRCCS Fondazione Stella Maris, Calambrone (PI)
3 Fondazione Toscana Gabriele Monasterio, Pisa
4IRCCS Ca' Granda Ospedale Maggiore di Milano Policlinico, Milano
Inibizione del fattore di trascrizione Nfix farmaco-mediata come nuova terapia per la distrofia muscolare di Duchenne - Report Finale
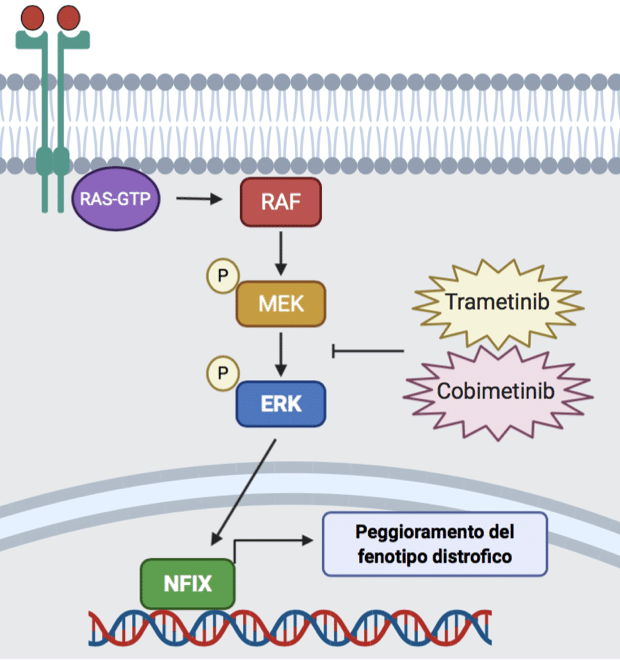
Finanziato da Parent Project aps, il progetto coordinato da Graziella Messina è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento detta Fast Track per l’importo di 20.000€. Il progetto è iniziato a febbraio del 2019 e ha avuto una durata di due anni. L'idea innovativa a cui si è dedicato il team di ricerca è stata quella di rallentare la rigenerazione muscolare favorendo un accumulo di fibre muscolari con un metabolismo ossidativo, note per essere più resistenti ai danni associati alla patologia. Il gruppo di ricerca della Professoressa Messina ha dimostrato che l’assenza del fattore di trascrizione Nfix, Nuclear Factor One, rallenta la rigenerazione e converte tutte le fibre muscolari a fibre a contrazione lenta.
I processi molecolari alla base dell’insorgenza e progressione delle distrofie muscolari non sono ancora completamente noti. Sebbene se ne conoscano le basi genetiche, la distrofia muscolare di Duchenne è una patologia complessa, nella quale diversi aspetti (come infiammazione, rigenerazione/degenerazione muscolare, tipologia dei muscoli interessati) compartecipano nel determinare il quadro diagnostico e di progressione. Comprendere questa complessità e i fattori coinvolti nella patologia consentirà di aumentare l’efficienza delle future terapie cellulari e geniche in corso di sviluppo.
Il fattore di trascrizione Nfix (Nuclear Factor One) è una delle proteine responsabili della progressione della distrofia muscolare di Duchenne. Nel laboratorio della Professoressa Messina è stato dimostrato che l’assenza di Nfix a livello genetico in topi distrofici determina un miglioramento sia fisiologico sia funzionale dei muscoli: minore infiammazione, minore degenerazione muscolare, minore fibrosi, migliore prestazione fisica.
L’obiettivo del gruppo di ricerca è stato quello di sviluppare un approccio farmacologico per inibire la proteina Nfix e ottenere un miglioramento istologico e funzionale nella distrofia muscolare di Duchenne.
Per inibire farmacologicamente una proteina è necessario conoscere bene quali sono i circuiti molecolari che la regolano nelle cellule, per poi potere interferire con essi dall’esterno.
Qualche anno fa, il gruppo di ricerca ha scoperto una delle vie di segnalazione che regolano i livelli del fattore Nfix nelle cellule muscolari: durante lo sviluppo e le fasi post-natali dei mioblasti, Nfix è regolato dalle MAP chinasi, in particolare dall’enzima ERK.
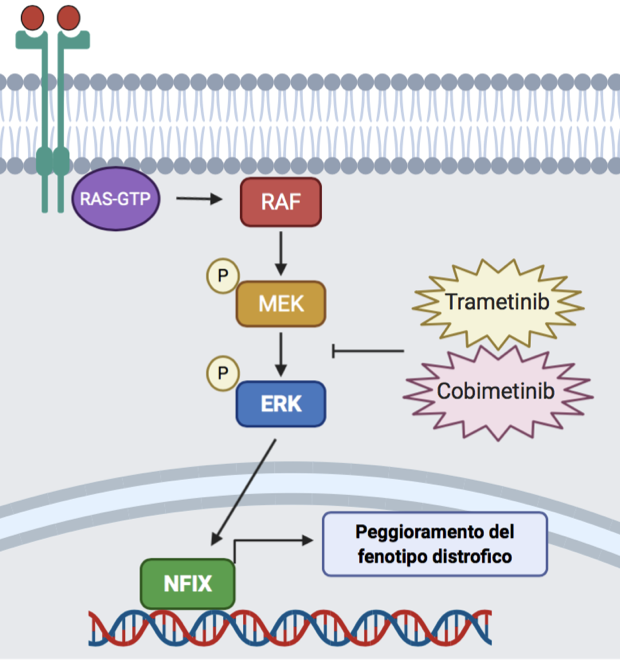
Grazie al contributo di Parent Project aps, il team ha deciso di indagare circa il possibile riutilizzo nella Duchenne del farmaco Trametinib (GSK) – già utilizzato in clinica per il trattamento del melanoma metastatico – in grado di inibire le MAP chinasi e ridurre l’attività dell’enzima ERK. Somministrando questo farmaco prima in culture cellulari in vitro e poi in un modello distrofico, il Sarcoglicano null, è stato osservato un buon livello di inibizione di Nfix. In particolare, topi distrofici adulti (topi Sgca null) trattati con il Trametinib per via orale tutti i giorni per 14 giorni a due dosi diverse (3 e 6 mg/kg) hanno mostrato una buona riduzione di Nfix (circa il 20%) nei muscoli rispetto al controllo.
Inoltre, i muscoli trattati con Trametinib presentavano un maggior numero di fibre muscolari lente a metabolismo ossidativo, note per essere più resistenti ai danni associati alla patologia. Tuttavia, per gli altri parametri morfologici muscolari analizzati (calibro delle miofibre, livelli di rigenerazione e necrosi, estensione aree di infiammazione, fibrosi) i ricercatori non hanno riscontrato dei cambiamenti significativi rispetto al gruppo controllo, ai dosaggi e tempistiche seguiti.
In modo completamente inatteso hanno, purtroppo, notato l’aumento di calcificazioni muscolari in seguito al trattamento con il farmaco. Hanno riscontrato tali alterazioni istologiche soltanto nei topi distrofici trattati e non in topi sani (wild-type) a cui sono stati somministrati gli stessi dosaggi di Trametinib alle stesse tempistiche.
Le calcificazioni muscolari indotte dal trattamento cronico del Trametinib non erano state mai descritte finora per il farmaco, i cui trial pre-clinici e clinici precedenti (necessari per il suo utilizzo in clinica) sono stati condotti su modelli animali e volontari/pazienti non affetti da distrofia muscolare di Duchenne.
Questo aspetto ha chiaramente rappresentato un ostacolo all’ulteriore sviluppo dello studio, limitando la possibilità di aumentare il dosaggio e/o le tempistiche di somministrazione del Trametinib che è in grado di diminuire Nfix nei muscoli distrofici in maniera non sufficiente a ottenere il miglioramento istologico sperato.
I risultati di questo progetto, sebbene non completamente positivi, hanno permesso di fare luce sulla regolazione di Nfix da parte delle MAPK ed ERK in un contesto distrofico.
Ciò consentirà di approfondire il legame tra ERK ed Nfix, riuscendo a trovare una interazione più diretta e testare farmaci sempre più specifici. Inoltre, in un processo di pura serendipity, tale correlazione tra ERK, distrofia e calcificazioni muscolari (mai descritta finora) apre le porte a numerose linee di ricerca per la comprensione dei meccanismi molecolari e cellulari alterati nella distrofia muscolare.
Riprogrammazione metabolica: una nuova strategia terapeutica per la distrofia muscolare di Duchenne - Report Finale
Finanziato da Parent Project aps, il progetto coordinato da Silvia Consalvi è uno dei tre che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento detta Grant Application, per l’importo di 80.000€. Il progetto è iniziato ad aprile del 2019 e ha avuto una durata di due anni. Il team di ricerca ha testato per la prima volta l’efficacia di un farmaco – SRT2104 – che potrebbe contribuire a estendere nel tempo l’efficacia di givinostat includendo, quindi, pazienti con distrofia muscolare di Duchenne in fase avanzata.
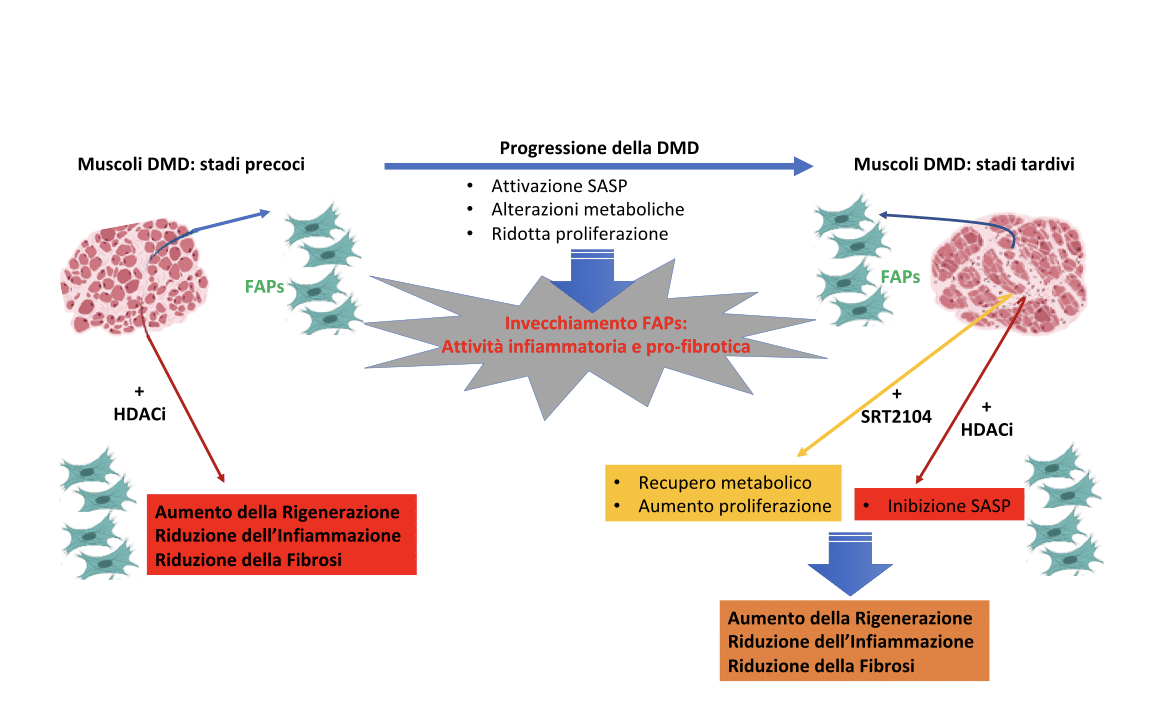
Il trattamento farmacologico della distrofia muscolare di Duchenne (DMD) con inibitori delle istone deacetilasi (HDACi) è attualmente in fase di sperimentazione in studi clinici di fase 3 con il farmaco givinostat; tuttavia, studi preclinici in modelli animali della DMD (topi mdx) hanno indicato che gli effetti benefici degli HDACi sono limitati agli stadi iniziali della malattia e vengono mediati prevalentemente da una popolazione cellulare, i progenitori fibroadipogenici (FAPs), che si trova negli interstizi del tessuto muscolare, dove svolge un ruolo chiave durante la rigenerazione muscolare (Mozzetta et al., 2013; Saccone et al., 2014). In particolare, gli HDACi inducono i FAPs a mantenere un’azione pro-rigenerativa e prevengono la loro conversione in effettori cellulari della degenerazione fibro-adiposa dei muscoli. Tuttavia questi effetti terapeutici degli HDACi sono circoscritti alle fasi precoci della patologia. La perdita degli effetti benefici degli HDACi, osservata negli stadi più avanzati della DMD, è almeno in parte dovuta allo sviluppo di una resistenza dei FAPs agli HDACi (Mozzetta et al., 2013; Saccone et al., 2014).
Il primo obiettivo di questo progetto è stato, pertanto, spiegare i meccanismi biologici alla base di tale resistenza, al fine di sviluppare nuove strategie terapeutiche che possano allungare la finestra temporale di azione degli HDACi.
Gli studi del team della dottoressa Consalvi hanno dimostrato che i FAPs di topi mdx in fase avanzata della patologia esibiscono un'attività HDAC aberrante e, conseguentemente, alterazioni a livello del genoma dell'acetilazione istonica che conferiscono una parziale resistenza al trattamento con HDACi (Consalvi et al., 2021). I FAPs mdx a stadio avanzato mostrano, infatti, una minore acetilazione sui promotori di geni coinvolti nella proliferazione, associata a una ridotta espressione genica. Queste alterazioni non possono essere contrastate dal trattamento con HDACi, a causa di una resistenza generale all'iperacetilazione indotta dagli HDACi. Al contempo, FAPs mdx a stadio avanzato esibiscono una maggiore acetilazione ed espressione dei geni coinvolti nel fenotipo secretorio associato alla senescenza (SASP). Sorprendentemente, su questa categoria di geni gli HDACi riducono i livelli di acetilazione ed espressione genica.
Questi dati rivelano che, durante la progressione della DMD, i FAPs sviluppano caratteristiche associate alla patologia che ricordano la senescenza, ovvero l’invecchiamento cellulare. La ridotta proliferazione e l’attivazione della SASP nei FAPs risultano, inoltre, eventi distinti correlati alla patologia e farmacologicamente dissociabili. Infatti, mentre gli HDACi falliscono nel ripristinare le capacità proliferative dei FAPs, riescono a inibire la SASP suggerendo che il trattamento possa mantenere l’effetto anti-fibrotico e anti-infiammatorio anche a stadi tardivi della patologia (Consalvi et al., 2021).
La proliferazione cellulare è un meccanismo biologico dal grande dispendio energetico e dunque intimamente legato alle capacità metaboliche delle cellule. Studi precedenti hanno analizzato la connessione tra proliferazione e metabolismo nei FAPs (Reggio et al., 2020). I dati hanno rivelato che durante la progressione della DMD, i FAPs sviluppano alterazioni nella funzionalità dei mitocondri, organelli che rappresentano la principale fonte di energia delle cellule. Tale deficit funzionale determina un aumento dello stress ossidativo che rafforza la SASP e compromette le capacità proliferative dei FAPs. In questo studio è stato, quindi, valutato il trattamento farmacologico con SRT2104, attivatore della Sirtuina1, quale agente in grado di promuovere l’attività mitocondriale. I risultati delle analisi hanno dimostrato che SRT2104 è stato in grado di incrementare le capacità metaboliche dei FAPs a stadi tardivi della DMD riportandole ai livelli dei FAPs a stadi precoci. Inoltre, il trattamento combinato di SRT2104 con givinostat ha permesso di recuperare l’attività mitocondriale e ridurre la SASP, ripristinando il tasso proliferativo dei FAPs. Questi dati suggeriscono che i due trattamenti farmacologici possano sinergizzare, determinando un “ringiovanimento” delle FAPs in grado di estendere gli effetti pro-rigenerativi degli HDACi anche a pazienti in stadi avanzati della DMD.

Rappresentazione schematica dell’effetto di HDACi e SRT2104 sui FAPs durante la progressione della DMD.
Referenze
Mozzetta C, Consalvi S, Saccone V, Tierney M, Diamantini A, Mitchel KJ, Marazzi G, Borsellino G, Battistini L, Sassoon D et al (2013). Fibroadipogenic progenitors mediate the ability of HDAC inhibitors to promote regeneration in dystrophic muscles of young, but not old mdx mice. EMBO Mol Med 5: 626-639
Saccone V, Consalvi S, Giordani L, Mozzetta C, Barozzi I, Sandoná M, Ryan T, Rojas-Muñoz A, Madaro L, Fasanaro P et al (2014) HDAC-regulated myomiRs control BAF60 variant exchange and direct the functional phenotype of fibro-adipogenic progenitors in dystrophic muscles. Genes Dev 28: 841-857
Consalvi S, Tucciarone L, Macrì E, De Bardi M, Picozza M, Salvatori I, Renzini A, Valente S, Mai A, Moresi V, Puri PL (2021). Partial resistance to HDAC inhibitors in FAPs of dystrophic muscles at late stages of disease is associated to epigenetic and transcriptional features of cellular senescence. BioRxiv doi: https://doi.org/10.1101/2021.04.26.441412
Reggio A, Rosina M, Krahmer N, Palma A, Petrilli LL, Maiolatesi G, Massacci G, Salvatori I, Valle C, Testa S et al (2020) Metabolic reprogramming of fibro/adipogenic progenitors facilitates muscle regeneration. Life Sci Alliance 3(3):e202000646
UN NUOVO APPROCCIO EPIGENETICO PER MIGLIORARE L’OMEOSTASI NELLA DISTROFIA MUSCOLARE DI DUCHENNE - REPORT FINALE
Finanziato da Parent Project aps, il progetto coordinato da Giuseppina Caretti è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento detta Fast Track, per l’ importo di 20.000€. Il progetto è iniziato a luglio del 2019 e ha avuto una durata di due anni. Precedenti studi del gruppo di ricerca hanno dimostrato che la somministrazione degli inibitori BET migliora la funzionalità e lo stato del muscolo in un modello per la distrofia muscolare di Duchenne (il topo mdx). L’obiettivo è stato capire se gli inibitori BET riducono la fibrosi nel modello di topo mdx e se il trattamento vada a influenzare l’azione delle cellule pre-fibrotiche. Gli inibitori BET sono una classe di farmaci che bloccano una famiglia di proteine contenenti bromodomini e domini extra-terminali (BET).
Nel secondo anno del progetto finanziato da Parent Project aps, il team della professoressa Caretti ha focalizzato l’attenzione su due modelli di studio:
- il modello murino mdx a un’età di 12 mesi, per verificare se gli effetti migliorativi del trattamento con l’inibitore di JQ1 (molecola in grado di prevenire l’atrofia muscolare e di ridurre i livelli di infiammazione) fossero osservabili anche quando alcune caratteristiche fisiopatologiche della patologia, quali la fibrosi, sono più evidenti
- un modello cellulare, derivato da cellule muscolari immortalizzate derivate da biopsie di pazienti affetti dalla distrofia muscolare di Duchenne.
Studiando l’impatto degli inibitori delle proteine BET in topi mdx di 12 mesi, in cui l’accumulo fibrotico è particolarmente accentuato, sono state osservate una riduzione dei livelli di proteine coinvolte nella fibrosi e la diminuzione della deposizione di fibre di collagene nei muscoli tibiali. Le analisi morfologiche con colorazioni particolari e analisi dei trascritti hanno confermato una riduzione della fibrosi dopo la somministrazione dell’inibitore. In questa fase della progressione della patologia, il trattamento con gli inibitori BET ha anche portato a una riduzione dei livelli di marcatori infiammatori quali TNFα e IL6, confermando i dati ottenuti in topi mdx più giovani e i risultati di altri gruppi di ricerca, che hanno mostrato come le proteine BET abbiano un ruolo fondamentale nel promuovere la risposta infiammatoria, in diverse patologie e contesti cellulari.
Per studiare i meccanismi molecolari alla base della riduzione dei livelli di infiammazione e fibrosi, sono state valutate le modulazioni di alcuni fattori trascrizionali ed epigenetici, coinvolti nella regolazione di molecole coinvolte in questi processi;in particolare, le modulazioni del fattore trascrizionale NFkB e della deacetilasi Sirt1, in seguito a trattamento con gli inibitori delle proteine BET, nel modello mdx e nei modelli cellulari.
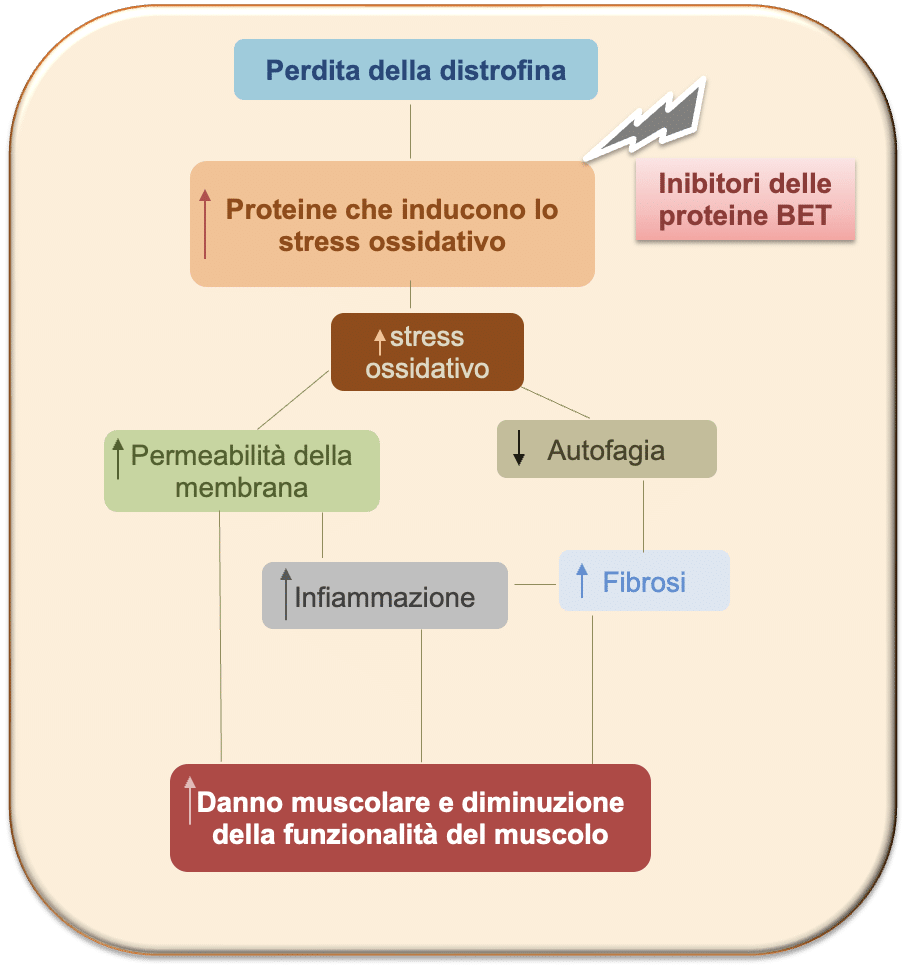
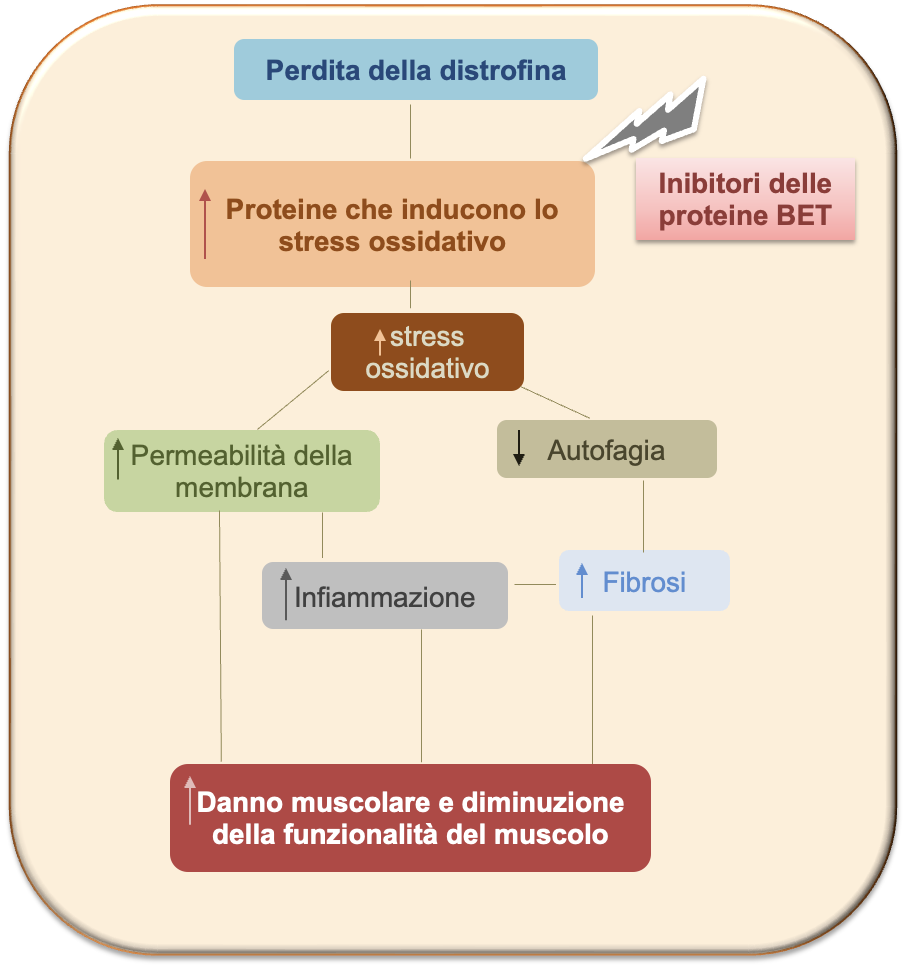
Infine, è stato utilizzato il modello derivato da cellule immortalizzate di mioblasti di pazienti Duchenne, al fine di confermare che i meccanismi di regolazione mediata dalle proteine BET, precedentemente osservate nel modello mdx, fossero rilevabili anche in questo modello cellulare. In particolare, l’attenzione del team di ricerca si è soffermata sul ruolo delle proteine BET nella regolazione dei livelli dei regolatori dello stress ossidativo e delle molecole pro-infiammatorie.
L’aumento dello stress ossidativo è un evento iniziale nello sviluppo della patologia del muscolo dei pazienti Duchenne e, a sua volta, causa necrosi delle cellule muscolari, inducendo danno muscolare e promuovendo l’infiltrato infiammatorio. Nel complesso, i dati di questo studio mostrano come quest’aumento dello stress ossidativo sia mediato, almeno in parte, dalle proteine BET, in particolare dalla proteina BRD4, che regola in modo diretto i livelli di proteine che portano alla formazione dei radicali liberi. Come noto dalla letteratura, l’aumento dello stress ossidativo è anche associato a un blocco del meccanismo di smaltimento di proteine e macromolecole non funzionanti, ossia l’autofagia, elemento caratteristico del muscolo distrofico. In seguito all’aumento dello stress ossidativo e al danno muscolare, incrementa anche l’infiammazione e di conseguenza l’induzione della fibrosi, ossia di diversi elementi che nel complesso portano a un peggioramento del danno muscolare, fino a compromettere la funzionalità del muscolo.
Come mostrato in figura, i dati sperimentali ottenuti nel modello mdx e nei modelli cellulari mostrano come gli inibitori delle proteine BET possano essere considerati modulatori importanti dello stress ossidativo e di conseguenza dei molteplici processi coinvolti nella fisiopatologia della distrofia di Duchenne.
Contrastare l’infiammazione muscolare nella DMD promuovendo l’attivazione dei macrofagi pro-rigenerativi e inibendo quelli infiammatori tramite farmaci che agiscono sul metabolismo cellulare - Report Finale
Il progetto è iniziato a marzo del 2019 ed è stato realizzato grazie alla collaborazione tra Elisabetta Ferraro, Francesca De Santa e Alessio Torcinaro. Finanziato da Parent Project aps, il progetto è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento alla ricerca detta Fast Track, per l’importo di 20.000€. Dati sempre più numerosi dimostrano che il metabolismo dei macrofagi infiammatori è diverso da quello dei macrofagi pro-rigenerativi e anti-infiammatori. L’obiettivo di questo studio è stato quello di stimolare il metabolismo di tipo mitocondriale tipico dei macrofagi anti-infiammatori al fine di contrastare l’infiammazione del muscolo distrofico e, al contempo, di promuoverne la rigenerazione.
Una corretta rigenerazione muscolare richiede la partecipazione di cellule del sistema immunitario definite macrofagi. Subito dopo un danno muscolare, il muscolo viene colonizzato da numerosi macrofagi pro-infiammatori (tipo M1) che poi vengono sostituiti da macrofagi con effetto anti-infiammatorio e rigenerativo (tipo M2). Viceversa, nella DMD, il danno muscolare è continuo, per cui si ha una presenza costante di macrofagi infiammatori, che risulta deleteria e contribuisce alla riduzione della capacità rigenerativa del muscolo scheletrico.
Le popolazioni macrofagiche di tipo M1 e di tipo M2 utilizzano vie metaboliche diverse per ricavare l’energia necessaria alla loro sopravvivenza. L’idea progettuale è stata quindi quella di stimolare i processi metabolici usati dai macrofagi M2 (metabolismo principalmente mitocondriale) per indurre la maturazione macrofagica verso il tipo M2 e contrastare la maturazione verso il tipo M1 infiammatorio, al fine di ridurre l’infiammazione cronica del muscolo distrofico.
A tal scopo è stato valutato, in vitro, l’effetto anti-infiammatorio di cinque molecole note per agire su vari processi metabolici (riboflavina-5’-fosfato/vitamina B2-fosfato, idebenone, ranolazina, trimetazidina e mildronato), che sono state somministrate a macrofagi murini trattati con uno stimolo pro-infiammatorio, il lipopolisaccaride. È stata valutata l’espressione genica di citochine infiammatorie, quali interleuchina-1beta e interleuchina-6, nonché quella della chemochina CCL2 e di molecole associate prevalentemente al fenotipo rigenerativo, come Arginasi-1 e CD206.
Tra le molecole che hanno indotto in vitro una risposta antiinfiammatoria (riboflavina-5’-fosfato, idebenone e ranolazina), la riboflavina-5’-fosfato e l’idebenone sono state testate in vivo utilizzando il modello murino per la distrofia muscolare di Duchenne (il topo mdx) mediante un trattamento a breve e uno a lungo termine. Il trattamento a breve termine è consistito in un mese di somministrazioni giornaliere (a partire da 2 mesi fino ai 3 mesi di età dei topi), mentre quello a lungo termine è consistito nel trattamento breve addizionato di cicli intermittenti (ogni due mesi) di due settimane di somministrazione fino all’età di 9 mesi.
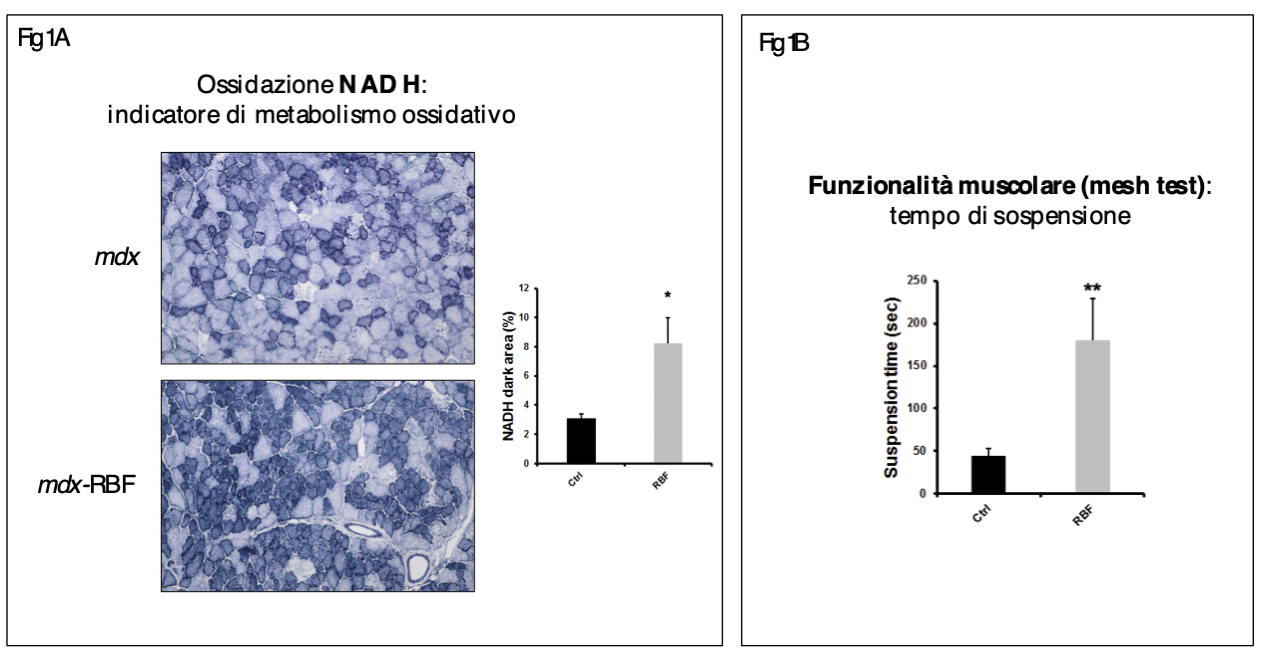
Riboflavina-5’-fosfato (1mg/topo/die; somministrazione intraperitoneale) - In seguito ai trattamenti con riboflavina-5’-fosfato, sia quello breve che quello lungo, il numero di fibre ossidative è aumentato in maniera considerevole (figura 1A) con una riduzione della fibrosi, dell'espressione del collagene e dell'infiltrato infiammatorio. Rispetto al trattamento breve, il trattamento lungo ha mostrato, inoltre, un maggiore e significativo incremento della funzionalità muscolare (figura 1B) e un aumento dei livelli di marcatori anti-infiammatori come Arginasi-1 e CD163. Inoltre, è risultata evidente e statisticamente significativa la riduzione delle fibre necrotiche in seguito al trattamento con riboflavina-5’-fosfato.

Idebenone (1mg/topo/die; somministrazione intraperitoneale) - Nonostante l’idebenone abbia rivelato un potente effetto anti-infiammatorio in vitro su macrofagi umani, il trattamento a breve termine sul modello murino mdx con idebenone non ha mostrato differenze significative dei parametri valutati rispetto agli animali non trattati. Tuttavia, il trattamento a lungo termine con questa molecola ha indotto un incremento del numero di fibre ossidative, anche se in misura minore rispetto alla riboflavina-5’-fosfato, una riduzione della fibrosi e dell'espressione del collagene e, solo nel 50% degli animali, una riduzione delle fibre necrotiche che si traduce in una assenza di riduzione statisticamente significativa delle fibre necrotiche. Infine, anche il trattamento lungo con idebenone, così come quello con riboflavina-5’-fosfato, ha indotto un significativo incremento della funzionalità muscolare.
Rispetto ad altre terapie anti-infiammatorie, l’uso di queste molecole in clinica potrebbe essere vantaggioso per il fatto che esse potrebbero svolgere contemporaneamente due ruoli: i) ridurre l’infiammazione e ii) promuovere la capacità rigenerativa del muscolo. Inoltre, i dati suggeriscono che queste molecole, poiché agiscono sul metabolismo, abbiano un effetto benefico diretto, oltre che sui macrofagi, anche sulle fibre muscolari il cui metabolismo, nei pazienti distrofici, è fortemente alterato.
Il Progetto ConSolidaRe: Emergency Card e non solo
Il nostro
progetto ConSolidaRe - Connessioni Solidali in Rete, che si è concluso a fine marzo, ha incluso
numerose attività legate all’Emergency Card, al Registro Pazienti, nonché alla
diffusione del Protocollo Nicholoff, fondamentale per la gestione
dell’emergenza nei pazienti che assumono cortisone.
Sono proseguite
le attività di implementazione e diffusione dell’Emergency Card, un
innovativo strumento per la gestione delle emergenze dei pazienti affetti da
distrofia muscolare di Duchenne/Becker.
L’Emergency
Card personale è un innovativo strumento per la gestione delle emergenze dei
pazienti affetti da distrofia muscolare di Duchenne/Becker. Si tratta di una
scheda stampabile da portare sempre con sé, in cui sono raccolte in modo
sintetico tutte le informazioni cliniche fondamentali e alcune importanti
indicazioni relative alle più frequenti complicanze della patologia.
Grazie al
progetto “Consolidare” sono stati compiuti diversi passi in avanti rispetto
alla diffusione di questo strumento, utilissimo per i pazienti con DMD o BMD
che si trovino ad affrontare un’emergenza medica: il 23 settembre è stato
infatti realizzato un webinar di presentazione per fornire maggiori
informazioni a famiglie e specialisti e il 20 febbraio si è tenuto un webinar
rivolto ai clinici.
Sono stati
realizzati e condivisi con tutta la rete di pazienti diversi materiali
informativi che sono stati spediti a casa a oltre 800 famiglie:
- la Brochure dedicata al Registro Pazienti, per presentare questo mezzo fondamentale per il dialogo tra la comunità di pazienti e la comunità scientifica;
- la Brochure Emergency Card, da utilizzare in situazioni di emergenza medica; il fascicolo contiene tutte le indicazioni dettagliate sulle possibili complicanze associate alla patologia e su come trattarle;
- una pen drive
utile per caricare la scheda personale che raggruppa tutti i dati anagrafici e
clinici del paziente e che il paziente (o il caregiver) può compilare
contattando Parent Project;
- la brochure Protocollo di PJ Nicholoff per i pazienti Duchenne e Becker in terapia steroidea: un materiale utile a fornire ai medici informazioni sulla gestione sicura dei corticosteroidi in situazioni di emergenza e su come prevenire l'astinenza da questi farmaci.
I materiali sono stati realizzati in un
formato comodo da portare sempre con sé per poter gestire al meglio
un'eventuale situazione di urgenza. L’Emergency Card è stata fornita anche in
lingua inglese, in modo che i pazienti possano portarla con sé anche in caso di
viaggi all’estero.
Le brochure informative verranno distribuite anche a Centri clinici e unità di
Pronto Soccorso ospedaliere, per informare e sensibilizzare sull’importanza
cruciale di un approccio alle emergenze che tenga conto del complesso quadro
clinico dei pazienti con DMD e sulle funzioni del Registro Pazienti.
Il progetto ConSolidaRe è stato finanziato dal Ministero del Lavoro e delle Politiche Sociali ai sensi dell’Avviso n. 2/2020 per il Finanziamento di iniziative e progetti di rilevanza nazionale ai sensi dell’articolo 72 del decreto legislativo 3 luglio 2017, n. 117 e s.m.i.- anno 2020.
Al via il progetto Limitless: vivere la disabilità oltre i confini
Un’iniziativa sull’accessibilità e il protagonismo giovanile a Torino
Ha preso
da poco il via il progetto Limitless: vivere la disabilità oltre i
confini, promosso da Parent Project aps, con il sostegno della Fondazione
CRT.
Attraverso
il progetto Parent Project promuoverà la cittadinanza attiva dei giovani con distrofia
muscolare di Duchenne e Becker. I
partecipanti saranno protagonisti della mappatura e costruzione di un
percorso accessibile in una delle zone di maggiore interesse della città di
Torino attraverso la app Kimap, elaborata dalla start-up Kinoa
Innovation Studio, la prima app per la mobilità ideata nell’ottica delle
persone con disabilità motoria.
Il programma comprenderà anche la
possibilità di sperimentare la guida di un drone per apprendere una nuova disciplina che potrà avere sbocchi lavorativi o sportivi.
Le attività coinvolgeranno ragazzi con e senza disabilità, in un’ottica
d’integrazione e reciproca crescita.
Il
progetto avrà inizio con due webinar, in programma il 22 aprile e il 13
maggio, alle ore 17. Nel primo incontro verrà presentata l’iniziativa,
mentre il secondo permetterà di introdurre una serie di aspetti tecnici e
burocratici legati al volo con il drone.
Le attività in presenza si svolgeranno nei mesi estivi.
Sono previste iniziative di comunicazione per disseminare i risultati del progetto e per condividere la mappatura realizzata dai giovani partecipanti.
Per partecipare/iscriversi ai webinar informativi scrivere a cadsardegna@parentproject.it e cadpiemonte@parentproject.it.
Si è concluso il Progetto ConSolidaRe
Le attività del secondo semestre del progetto ConSolidaRe - Connessioni Solidali in Rete.
Si è da
poco concluso ConSolidaRe -
Connessioni Solidali in Rete, progetto di Parent Project aps.
Il progetto ha avuto l’obiettivo
di avviare un lavoro specifico sulle comunità,
estendendo le iniziative di attivazione e coinvolgimento a tutti gli ambiti
comunitari connessi alle attività di Parent Project, dalle famiglie agli
operatori e alle nuove figure professionali emergenti, dai pazienti adulti a
quelli più giovani, dalla Scuola alla Comunità Scientifica, dalle reti del
Terzo Settore alle Istituzioni, a livello locale, nazionale ed europeo.
Il
progetto è stato finanziato dal Ministero del Lavoro e delle Politiche Sociali
ai sensi dell’Avviso n. 2/2020 per il Finanziamento di iniziative e progetti di
rilevanza nazionale ai sensi dell’articolo 72 del decreto legislativo 3 luglio
2017, n. 117 e s.m.i.- anno 2020.
Ecco le principali attività realizzate
nel secondo e ultimo semestre di ConSolidaRe.
Sperimentazione dell’Emergency Card
Sono
proseguite le attività di implementazione e diffusione di questo innovativo
strumento per la gestione delle emergenze dei pazienti affetti da distrofia
muscolare di Duchenne/Becker.
Ad oggi sono
state compilate e aggiornate 106 card. Sono stati realizzati e condivisi con
tutta la rete di pazienti diversi materiali informativi che riguardano sia
l’Emergency Card, sia il Registro Pazienti.
Telemedicina cardiologica
È proseguita e
si è conclusa con successo la sperimentazione della telemedicina cardiologica,
che ha visto la partecipazione di 45 pazienti. il cardiologo incaricato si è occupato di visitare i pazienti con la
Duchenne e la Becker in modalità telematica. La sperimentazione ha ottenuto un
notevole successo e l’associazione ha reperito le risorse per dare continuità a
questo servizio anche dopo la conclusione di ConSolidaRe.
Campagna di comunicazione
Nei mesi di novembre e dicembre è stata diffusa la campagna di
comunicazione “Poteva andarmi peggio”, curata dall’agenzia KIRweb. Nel primo
semestre si è lavorato sulla valutazione delle proposte della campagna pervenute
e sulla programmazione. Il processo decisionale ha coinvolto non solo membri dello staff e della
governance, ma anche giovani della Consulta e Delegati territoriali. La
campagna, giocando su un concept provocatorio, ha voluto invitare il pubblico a
conoscere la DMD/BMD e a sostenere la ricerca, al contempo smontando alcuni
meccanismi nella rappresentazione della disabilità. L’iniziativa è stata
ripresa dai media a livello nazionale e ha visto una forte partecipazione e un
acceso dibattito sui canali social media dell’associazione.
Rafforzamento della Consulta dei Ragazzi
Dopo le attività del primo
semestre e l’esperienza di vita indipendente nel mese di giugno, il secondo
semestre ha visto alcuni ulteriori passi in avanti. I membri della Consulta
hanno iniziato a partecipare come uditori ad alcune riunioni del consiglio
direttivo, hanno avanzato proposte di progetti da portare avanti e vengono
costantemente coinvolti in alcune decisioni inerenti sia le attività
progettuali che associative in generale.
Percorso Fisioterapisti e OSS/OSA
Nel primo
semestre i Centri Ascolto Duchenne hanno curato una mappatura della situazione
riguardante la presa in carico fisioterapica e assistenziale dei pazienti,
attraverso la somministrazione di un questionario a tutte le famiglie. Nel
secondo semestre si è cercato di realizzare una mappatura dei Centri
fisioterapici e delle Asl al fine di procedere con una presentazione
dell'associazione.
Valorizzazione del ruolo del Delegato Territoriale
Nei primi mesi
è stata effettuata una valutazione insieme ai delegati in carica attraverso
singole riunioni e telefonate ed è stato somministrato un questionario agli
operatori dei CAD per valutare ed ottimizzare il rapporto tra delegato ed operatore
territoriale. Il lavoro è proseguito con l’organizzazione di incontri di
formazione su argomenti specifici per favorire il coinvolgimento dei delegati
(5x1000, RePa, campagna di sensibilizzazione). Nel complesso si sono tenuti 11
incontri di formazione alla rappresentatività territoriale con 34 partecipanti
e nel corso dell’anno è aumentata la presenza di rappresentanti di Parent Project
ai tavoli istituzionali e ad iniziative esterne.
Innovazione tecnologica rete
Nel corso del
secondo semestre è proseguita l’implementazione di un nuovo programma di
contabilità - utile anche alla redazione del bilancio sociale -, e di nuovi
database per le campagne di raccolta fondi e i relativi donatori, per le
attività dei Centri ascolto e la gestione dei dati delle famiglie.