Finanziato da Parent Project aps, il progetto coordinato da Graziella Messina è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento detta Fast Track per l’importo di 20.000€. Il progetto è iniziato a febbraio del 2019 e ha avuto una durata di due anni. L’idea innovativa a cui si è dedicato il team di ricerca è stata quella di rallentare la rigenerazione muscolare favorendo un accumulo di fibre muscolari con un metabolismo ossidativo, note per essere più resistenti ai danni associati alla patologia. Il gruppo di ricerca della Professoressa Messina ha dimostrato che l’assenza del fattore di trascrizione Nfix, Nuclear Factor One, rallenta la rigenerazione e converte tutte le fibre muscolari a fibre a contrazione lenta.
I processi molecolari alla base dell’insorgenza e progressione delle distrofie muscolari non sono ancora completamente noti. Sebbene se ne conoscano le basi genetiche, la distrofia muscolare di Duchenne è una patologia complessa, nella quale diversi aspetti (come infiammazione, rigenerazione/degenerazione muscolare, tipologia dei muscoli interessati) compartecipano nel determinare il quadro diagnostico e di progressione. Comprendere questa complessità e i fattori coinvolti nella patologia consentirà di aumentare l’efficienza delle future terapie cellulari e geniche in corso di sviluppo.
Il fattore di trascrizione Nfix (Nuclear Factor One) è una delle proteine responsabili della progressione della distrofia muscolare di Duchenne. Nel laboratorio della Professoressa Messina è stato dimostrato che l’assenza di Nfix a livello genetico in topi distrofici determina un miglioramento sia fisiologico sia funzionale dei muscoli: minore infiammazione, minore degenerazione muscolare, minore fibrosi, migliore prestazione fisica.
L’obiettivo del gruppo di ricerca è stato quello di sviluppare un approccio farmacologico per inibire la proteina Nfix e ottenere un miglioramento istologico e funzionale nella distrofia muscolare di Duchenne.
Per inibire farmacologicamente una proteina è necessario conoscere bene quali sono i circuiti molecolari che la regolano nelle cellule, per poi potere interferire con essi dall’esterno.
Qualche anno fa, il gruppo di ricerca ha scoperto una delle vie di segnalazione che regolano i livelli del fattore Nfix nelle cellule muscolari: durante lo sviluppo e le fasi post-natali dei mioblasti, Nfix è regolato dalle MAP chinasi, in particolare dall’enzima ERK.
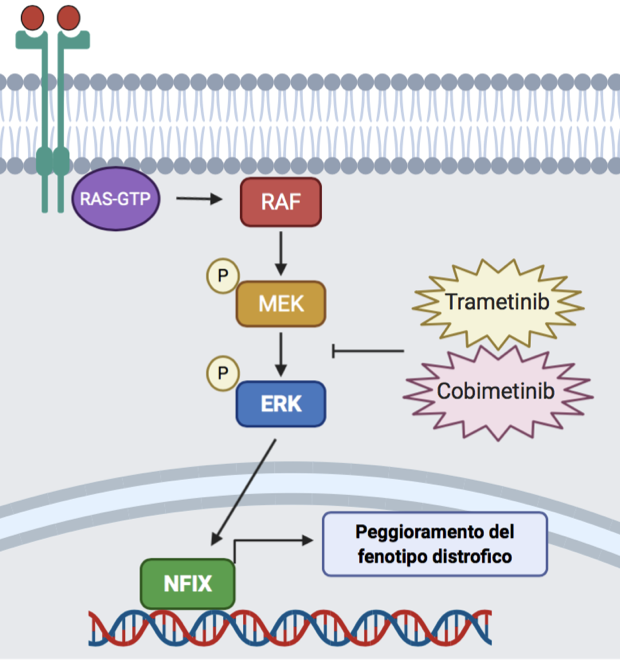
Grazie al contributo di Parent Project aps, il team ha deciso di indagare circa il possibile riutilizzo nella Duchenne del farmaco Trametinib (GSK) – già utilizzato in clinica per il trattamento del melanoma metastatico – in grado di inibire le MAP chinasi e ridurre l’attività dell’enzima ERK. Somministrando questo farmaco prima in culture cellulari in vitro e poi in un modello distrofico, il Sarcoglicano null, è stato osservato un buon livello di inibizione di Nfix. In particolare, topi distrofici adulti (topi Sgca null) trattati con il Trametinib per via orale tutti i giorni per 14 giorni a due dosi diverse (3 e 6 mg/kg) hanno mostrato una buona riduzione di Nfix (circa il 20%) nei muscoli rispetto al controllo.
Inoltre, i muscoli trattati con Trametinib presentavano un maggior numero di fibre muscolari lente a metabolismo ossidativo, note per essere più resistenti ai danni associati alla patologia. Tuttavia, per gli altri parametri morfologici muscolari analizzati (calibro delle miofibre, livelli di rigenerazione e necrosi, estensione aree di infiammazione, fibrosi) i ricercatori non hanno riscontrato dei cambiamenti significativi rispetto al gruppo controllo, ai dosaggi e tempistiche seguiti.
In modo completamente inatteso hanno, purtroppo, notato l’aumento di calcificazioni muscolari in seguito al trattamento con il farmaco. Hanno riscontrato tali alterazioni istologiche soltanto nei topi distrofici trattati e non in topi sani (wild-type) a cui sono stati somministrati gli stessi dosaggi di Trametinib alle stesse tempistiche.
Le calcificazioni muscolari indotte dal trattamento cronico del Trametinib non erano state mai descritte finora per il farmaco, i cui trial pre-clinici e clinici precedenti (necessari per il suo utilizzo in clinica) sono stati condotti su modelli animali e volontari/pazienti non affetti da distrofia muscolare di Duchenne.
Questo aspetto ha chiaramente rappresentato un ostacolo all’ulteriore sviluppo dello studio, limitando la possibilità di aumentare il dosaggio e/o le tempistiche di somministrazione del Trametinib che è in grado di diminuire Nfix nei muscoli distrofici in maniera non sufficiente a ottenere il miglioramento istologico sperato.
I risultati di questo progetto, sebbene non completamente positivi, hanno permesso di fare luce sulla regolazione di Nfix da parte delle MAPK ed ERK in un contesto distrofico.
Ciò consentirà di approfondire il legame tra ERK ed Nfix, riuscendo a trovare una interazione più diretta e testare farmaci sempre più specifici. Inoltre, in un processo di pura serendipity, tale correlazione tra ERK, distrofia e calcificazioni muscolari (mai descritta finora) apre le porte a numerose linee di ricerca per la comprensione dei meccanismi molecolari e cellulari alterati nella distrofia muscolare.
