Congresso "La patologia neuromuscolare dal bambino all’età adulta: nuovi strumenti e nuove opportunità"
Venerdì 23 e Sabato 24 Settembre si svolgerà a Pisa, presso l’Hotel Galilei, il congresso "La patologia neuromuscolare dal bambino all’età adulta: nuovi strumenti e nuove opportunità".
A portare la voce di Parent Project come organizzazione di pazienti sarà Nicoletta Madia, responsabile della raccolta fondi, comunicazione e relazioni internazionali dell'associazione.
Scarica il programma
Parent Project a "Canelli città del vino"
L'FDA concede l'approvazione accelerata per il primo farmaco per la Distrofia Muscolare di Duchenne
19 settembre 2016 la statunitense Food and Drug Administration ha approvato oggi l'iniezione di Exondys51 (eteplirsen), il primo farmaco approvato per il trattamento dei pazienti con Distrofia Muscolare di Duchenne (DMD). Exondys51 è specificatamente indicato per i pazienti che hanno una mutazione confermata nel gene della distrofina trattabile con lo skipping dell'esone 51, che colpisce circa il 13% della popolazione DMD.
"I pazienti con un particolare tipo di Distrofia Muscolare di Duchenne avranno ora accesso ad un trattamento approvato per questa patologia rara e devastante " ha detto Janet Woodcock, M.D, direttore dell'FDA center for drug evaluation and research. "Nelle patologie rare lo sviluppo di nuovi farmaci è particolarmente difficile a causa del piccolo numero di persone affette da ogni patologia e dalla mancanza della compressione degli aspetti medici di molte di loro. L'approvazione accelerata rende questo farmaco disponibile ai pazienti sulla base dei dati iniziali, ma aspettiamo con impazienza di saperne di più rispetto all'efficacia di questo farmaco attraverso uno studio clinico di conferma che la company deve condurre dopo l'approvazione".
La DMD è una patologia genetica rara caratterizzata dalla progressiva degenerazione e debolezza muscolare. È la forma più comune di Distrofia Muscolare. La DMD è causata dall'assenza di distrofina, una proteina che aiuta a mantenere intatte le cellule muscolari. I primi sintomi vengono solitamente osservati tra i 3 e i 5 anni di età e peggiorano nel tempo. La patologia spesso si presenta in persone che non hanno una storia familiare nota e colpisce principalmente i ragazzi, ma in casi rari può colpire le ragazze. La DMD colpisce 1:3600 bambini maschi nel mondo.
I ragazzi con la DMD perdono progressivamente la capacità di eseguire attività in modo indipendente e spesso necessitano dell'uso di una carrozzina nella prima adolescenza. Quando la patologia progredisce sono necessari trattamenti per il cuore e la respirazione. Solitamente i pazienti soccombono alla patologia tra i 20 e i 30 anni; tuttavia la gravità della patologia e l'aspettativa di vita è variabile.
Exondys51 è stato approvato secondo il percorso di approvazione accelerata che fornisce l'approvazione di quelle molecole rivolte al trattamento di patologie gravi o che limitano la sopravvivenza e che fornisono generalmente un vantaggio significativo rispetto ai trattamenti esistenti. L'approvazione mediante questo percorso può essere basata su studi adeguati e ben controllati che dimostrano che il farmaco ha un effetto su un endpoint surrogato che è ragionevolmene probabile predire un beneficio clinico ai pazienti (come si sente il paziente o la sua funzionalità o la soprvvivenza). Questo percorso consente un acceso precoce ai pazienti a nuovi farmaci promettenti mentre la company conduce studi clinici per verificare il beneficio clinico predetto.
L'approvazione accelerata di Exondys51 si basa sull'endpoint surrogato dell'aumento di distrofina nel muscolo scheletrico osservato in alcuni pazienti trattati con Exondys51. L'FDA ha concluso che i risultati sottomessi dal richiedente hanno dimostrato un aumento della produzione di distrofina che è ragionevolmente probabile predire un beneficio clinico in alcuni pazienti con DMD che hanno una mutazione confermata nel gene della distrofina trattabile con lo skipping dell'esone 51. Un beneficio clinico di Exondys51, includendo un miglioramento della funzione motoria, non è stato stabilito. Nel prendere questa decisione, l'FDA ha considerato i potenziali rischi associati al farmaco, la natura debiitante e limitante la sopravivvenza della patologia per questi bambini e l'assenza di una terapia disponibile.
In base alle disposizioni dell'approvazione accellerata, l'FDA chiede a Sarepta Therapeutics di condurre uno studio clinico che confermi il beneficio clinico della molecola. Lo studio richiesto è progettato per valutare se Exondys51 migliora la funzionalità motoria dei paienti DMD con una mutazione confermata del gene della distrofina trattabile con lo skipping dell'esone 51. Se lo studio clinico non riesce a dimostrare il beneficio clinico, l'FDA potrebbe iniziare le procedure per ritirare l'approvazione della molecola.
Gli effetti collaterali più comuni riportati dai partecipanti che hanno assunto Exondys51 negli studi clinici sono stati disturbi nell'equilibrio e vomito.
L'FDA ha concesso la designazione fast track per Exondys51, che è una designazione volta a facilitare lo sviluppo e velocizzare il processo di revisione di farmaci che mirano al trattmento di patologie gravi e che dimostrano il potenziale per rispondere al bisogno medico insoddisfatto. È stata anche concessa la priority review e la designazione di farmaco orfano. Lo stato di priority review è concesso alle richieste per farmaci che, se approvati, rappresenterebbero un miglioramento significativo nella sicurezza o efficacia nel trattamento di una patologia grave. La designazione di farmaco orfano fornisce incentivi come i crediti sulle tasse per gli studi clinici, esenzione dalla tasse dell'utilizzatore e l'elegibilita' per l'esclusivita sul farmaco orfano, per assistere e incoraggiare lo sviluppo di farmaci per le patologie rare.Il produttore ha ricevuto un voucher di priority review per una patologia pediatrica rara che proviene da un programma volto a incoraggiare lo sviluppo di nuovi farmaci e molecole biologiche per la prevenzione e il trattamento di patologie pediatriche rare. Questo è il settimo voucher di priority review per una patologia pediatrica rara emesso dall'FDA da quando è stato istituito il programma.
Exondys51 è prodotto da Sarepta Therapeutics di Cambridge, Massachusetts.
L'FDA, un'agenzia all'interno del dipartimento della salute e servizi per l'uomo statunitense, protegge la salute pubblica assicurando la sicurezza, efficacia dei farmaci umani e veterinari, dei vaccini e altri prodotti biologici per uso umano e strumentazioni mediche. L'agenzia è anche responsabile della sicurezza delle scorte di cibo della nostra nazione, dei cosmetici degli integratori dei prodotti che emettono radiazioni elettroniche e per la regolamentazione dei prodotti derivati dal tabacco.
Traduzione a cura dell'Ufficio Scientifico di Parent Project onlus.
Ghirano In... Forma!
Domenica 25 Settembre, ore 16:00
Ghirano di Prata di Pordenone
 Domenica 25 Settembre, in occasione della Sagra del Baccalà, un pomeriggio di sport e solidarietà a favore di Parent Project onlus.
Domenica 25 Settembre, in occasione della Sagra del Baccalà, un pomeriggio di sport e solidarietà a favore di Parent Project onlus.
Grazie al sostegno di istruttori professionisti, ci sarà la possibilità di praticare:
ore 14:00 - Spinning e walking - Body Center di Cordenons;
ore 15:00 - Zumba - Cinzia Piscopo e Dance Mob;
ore 16:00 - Aerobica Fitness – Gruppo Mo.re.Ale;
ore 17:00 - Danza del Ventre con Le Danzatrici di Amira.
Per info e pre-iscrizione:
Lara 335/7524584
Arriva “Aiutiamoci.net”: un portale web per promuovere l’autonomia dei giovani disabili
Parent Project onlus ha creato una piattaforma per lo scambio tra domanda e offerta di assistenza
Parent Project onlus, l’associazione di genitori di bambini e ragazzi affetti da distrofia muscolare di Duchenne e Becker, ha lanciato di recente il sito Aiutiamoci.net: un’innovativa piattaforma che promuoverà l’incontro tra domanda e offerta di servizi dedicati a giovani e adulti che convivono con varie forme di disabilità motoria, per favorire sempre di più una loro vita attiva e indipendente.
Aiutiamoci.net è un sito dedicato a giovani e adulti diversamente abili e operatori/operatrici qualificati. I servizi potranno essere di diverse tipologie, dal semplice accompagnamento in auto all’assistenza in casa per chi sperimenta la vita in un’abitazione autonoma.
La piattaforma web prevede due tipi di profili utente: quello per la persona disabile o per le famiglie e quello per l’assistente. Per accedere al portale sarà necessario registrarsi. I costi del servizio di assistenza saranno a carico dell’utente; è previsto un meccanismo di valutazione reciproca attraverso feedback visibili all’interno del forum.
Un’importante problematica che vivono le persone con disabilità motoria è il contrasto tra il crescente bisogno di autonomia dal nucleo familiare che caratterizza ogni giovane, e le necessità di assistenza personale che derivano dalla propria condizione di salute.
L’intento di Aiutiamoci.net è quello di dare un supporto a giovani e adulti con disabilità nell’elaborare un proprio progetto di vita il più autonomo possibile (dalla socialità nel tempo libero agli studi universitari). Il sostegno dei familiari, infatti, con l’avvicinarsi all’età adulta, può non essere più sufficiente o adeguato a queste nuove esigenze: una persona esterna al nucleo, debitamente formata e possibilmente di età più vicina a quella dei ragazzi, può rappresentare una soluzione ottimale per contribuire a costruire una vita più indipendente.
La creazione di questo portale si inserisce nell’ambito di “RE.A.L.T.A’. REte Assistenza Lavoro Tempo libero e Autonomia. Iniziativa di formazione e innovazione per sperimentare il Matching domanda/offerta tra operatori esperti e famiglie dei ragazzi DMD/DMB”, finanziata dal Ministero del Lavoro e delle Politiche Sociali ai sensi della L.383/2000, art. 12, comma 3, lett.d - Linee di indirizzo annualità 2014, finalizzata a migliorare la qualità di vita dei giovani che convivono con la distrofia muscolare di Duchenne e Becker, promuovendo una loro piena inclusione e un’attiva partecipazione sociale.
Per informazioni:
Elena Poletti
Tel. 331/6173371 – e.poletti@parentproject.it
www.parentproject.it
Il rugby piemontese in pista per placcare la distrofia
Si è svolto domenica 11 settembre, allo Stadio Primo Nebiolo di Torino, il Trofeo delle Alpi, un grande “torneo del cuore” a favore di Parent Project. Una giornata di festa, ricca di emozioni, dedicata al rugby a 360 gradi, per sostenere la ricerca sulla distrofia muscolare di Duchenne, come recita lo slogan “Placchiamo insieme la distrofia”. Un’idea nata da un giovane papà, Riccardo Sanna, ex rugbista che ha deciso di coinvolgere l’intero mondo del rugby piemontese in un grande torneo solidale. L’idea è piaciuta, ed ha permesso di coinvolgere moltissime persone e realtà che hanno dedicato generosamente energie, risorse ed entusiasmo all’evento, contribuendo in modo determinante al suo successo, in un bellissimo lavoro di squadra.
Al fianco di Parent Project hanno organizzato l’iniziativa il Comitato Rugby Piemonte e Coldiretti Torino; la Città di Torino, il Consiglio Regionale del Piemonte e la Circoscrizione III del Comune di Torino hanno concesso il loro patrocinio.
Testimonial speciale della giornata è stato Valerio Bernabò, seconda linea della Nazionale Italiana di rugby, che ha dedicato uno speciale messaggio a tutti i bambini e ragazzi che convivono con la DMD/BMD:
«Il rugby ci ha insegnato fin da piccoli l'importanza del sostegno reciproco. Una giornata come questa é una buona occasione per dare una mano a sostenere la ricerca. Ai bambini e ai ragazzi posso dire di non mollare mai. Loro sono il nostro esempio, con tutto quello che riescono a dare e a vivere. Anche il loro sorriso ci insegna tanto. Non possiamo fare altro che sostenerli e tifare per loro».
La giornata si è aperta con un torneo Under 14 tra CUS Torino, VII, Monferrato e San Mauro. E’ seguita una partita femminile tra la squadra del CUS ed una selezione regionale, e poi il torneo Seniores, tra le principali squadre regionali: in campo CUS, VII, Monferrato e Biella.
Sono risultate vincitrici le squadre CUS sia nel torneo Under 14, sia nell’incontro femminile e nel seniores. Alle 17.30, la squadra “mixed abilities” Settimo CROn, che coinvolge anche persone con disabilità, ha incontrato sul campo il Volvera e il Savona. Questa scelta ha avuto l’obiettivo di sottolineare la grandissima importanza dello sport come strumento di integrazione, socializzazione e rafforzamento dell’autostima.
Tutta la giornata è stata un’occasione di incontro e di socialità non solo per gli appassionati di rugby, ma per numerosi visitatori che hanno scelto di trascorrere alcune ore in convivialità, partecipando all’iniziativa di raccolta fondi. I più piccoli hanno potuto divertirsi anche con il truccabimbi e con le bolle e i palloncini distribuiti allo stand di Parent Project.
Numerose famiglie di Parent Project hanno partecipato all’evento, contribuendo a rendere l’atmosfera ancora più calorosa e creando un bel momento di condivisione.
Presso gli stand del birrificio artigianale BEFeD e dell’Agrigelateria San Pè, per tutta la giornata sono stati distribuiti sfiziosi spuntini e ottimi gelati; una parte dell'incasso sarà devoluta alla ricerca sulla distrofia muscolare di Duchenne e Becker.
Dalle ore 18.30 ha avuto inizio la premiazione, vivacizzata dall’ironia e dalla verve del presentatore, Marco Berry, con la partecipazione di Nicoletta Madia, responsabile Raccolta fondi dell’associazione. Dopo le 19.30 ha avuto inizio una frizzante serata di animazione e musica, con l’esibizione del comico Maurizio Lastrico e della rock band Dieci100.
Si sono appena spenti i riflettori sulla prima edizione del Trofeo delle Alpi, ma la squadra organizzativa non si ferma…bolle già in pentola una seconda edizione, sempre all’insegna dello sport, del divertimento e della solidarietà!
Convegno "L’alimentazione nei pazienti neuromuscolari"
 Segnaliamo il convegno "L’alimentazione nei pazienti neuromuscolari" che si svolgerà a Molfetta, in data 24 Settembre 2016.
Segnaliamo il convegno "L’alimentazione nei pazienti neuromuscolari" che si svolgerà a Molfetta, in data 24 Settembre 2016.
Il convegno, organizzato dal comitato pugliese di Mitocon, IMP e Coordinamento Associazioni Malattie Rare, si svolgerà presso la Scuola Media Poli, in Via Molfettesi d'Argentina 11/A.
Scarica il programma
“Clinical Trial on a chip”: prima del paziente la sperimentazione clinica passa per un chip.
Tecniche avanzate di microingegneria per creare un modello miniaturizzato in vitro del processo di differenziamento e rigenerazione muscolare per testare le strategie terapeutiche per la DMD. Su questa tecnologia innovativa si è basato uno studio italiano per valutare l’efficacia della terapia cellulare con mesoangioblasti. Un approccio che apre nuove interessanti prospettive per lo sviluppo dei futuri studi clinici.
di Francesca Ceradini
Riuscire a ripristinare un’adeguata produzione di distrofina nelle cellule muscolari è uno dei principali 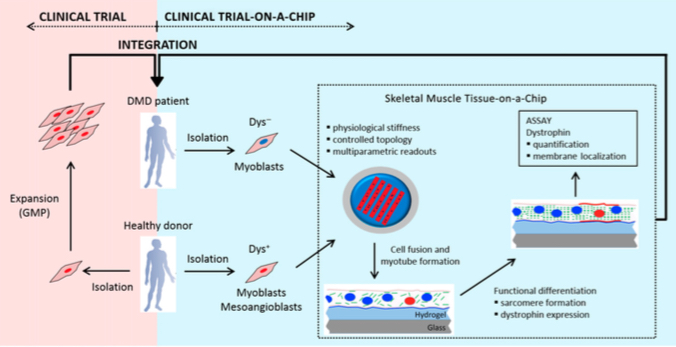 obiettivi che si pongono da anni i ricercatori per combattere la distrofia muscolare di Duchenne. Uno dei punti cruciali, durante gli studi preclinici e clinici, è quantificare la produzione di nuova distrofina funzionante e valutare se i livelli siano sufficienti per arrestare la degenerazione muscolare. Tutta una serie di studi indicano che il 30% di produzione di distrofina potrebbe bastare per contrastare la Duchenne, ma i dati accumulati negli ultimi anni hanno mostrato che i livelli di distrofina prodotta sono molto variabili, a seconda degli approcci terapeutici e delle condizioni dei trial, e purtroppo spesso insufficienti.
obiettivi che si pongono da anni i ricercatori per combattere la distrofia muscolare di Duchenne. Uno dei punti cruciali, durante gli studi preclinici e clinici, è quantificare la produzione di nuova distrofina funzionante e valutare se i livelli siano sufficienti per arrestare la degenerazione muscolare. Tutta una serie di studi indicano che il 30% di produzione di distrofina potrebbe bastare per contrastare la Duchenne, ma i dati accumulati negli ultimi anni hanno mostrato che i livelli di distrofina prodotta sono molto variabili, a seconda degli approcci terapeutici e delle condizioni dei trial, e purtroppo spesso insufficienti.
Esistono diversi modi per aumentare l’efficacia di una strategia ma non è possibile sviluppare un trial clinico per ognuno di essi. Come tutti sappiamo i trial sono uno step decisivo per l’approvazione di una nuova terapia ma sono anche molto dispendiosi sia in termini di soldi che in termini di tempo e fatica (non solo per ricercatori e industria ma anche per i pazienti). Sarebbe quindi molto utile avere a disposizione uno strumento propedeutico alla pianificazioni di nuovi studi clinici, che possa testare tutta una serie di variabili e dare precise informazioni sull’efficacia di una strategia prima di provarla sui pazienti. Ed è proprio da quest’idea che è nato il concetto di “clinical trial on a chip”. Si tratta di un innovativo modello di studio in vitro, basato sugli ultimi progressi della microingegneria per lo sviluppo di organi 3-D e di tessuti in microscala, progettato per la valutazione di nuovi farmaci. In poche parole un nuovo strumento hi-tech, piccolo, economico e rapido che mima gli studi clinici sui pazienti.
Nell’ambito degli studi sui processi fisiologici e patologici del tessuto muscolare scheletrico, interessanti ricerche basate sulla microingegneria sono state condotte da un gruppo di ricerca guidato da Nicola Elvassore, del Dipartimento di Ingegneria Industriale dell’Università di Padova. Nel 2010 i ricercatori italiani hanno messo a punto un modello in vitro su “chip” per lo sviluppo e il differenziamento dei miotubi, le unità funzionali del tessuto muscolare scheletrico. Su questo “chip”, costituito da un substrato polimerico e che comprende anche stimoli meccanici e topologici, i mioblasti (le cellule muscolari) sono in grado di proliferare e differenziare in miotubi che producono correttamente la distrofina (sia per quantità sia per distribuzione nella membrana) e che mimano la situazione fisiologica in vivo delle fibre muscolari mature. Inoltre, partendo da mioblasti prelevati da pazienti DMD, i ricercatori sono riusciti a riprodurre lo sviluppo di miotubi con la mutazione genetica responsabile della Duchenne. Un prezioso modello in vitro per lo studio della patologia.
Nell’ultimo studio, pubblicato ad agosto sulla rivista Stem Cells Translational Medicine, il team di Padova - in collaborazione con Giulio Cossu e Francesco Saverio Tedesco – ha utilizzato il modello di “clinical trial on a chip” per testare la terapia cellulare basata sui mesoangioblasti come strategia terapeutica attualmente in studio per la DMD. I mesoangioblasti sono particolari cellule staminali, associate ai vasi sanguigni, identificate e caratterizzate da Giulio Cossu nel 2002 come cellule capaci di rigenerare il tessuto muscolare danneggiato e ripristinare la sua funzionalità. Gli studi di Cossu hanno condotto nel 2011 al primo trial clinico con mesoangioblasti da donatore immunologicamente compatibile in 5 pazienti Duchenne, studio che si è dimostrato sicuro ma poco efficace.
Nello specifico, i ricercatori hanno testato la capacità che hanno i mesoangioblasti umani di ripristinare una corretta produzione e distribuzione della distrofina in mioblasti con una mutazione per la DMD (che non esprimono la proteina). Gli esperimenti sono stati condotti mettendo sul “chip” mioblasti “distrofici” in co-coltura con mesoangioblasti o mioblasti “sani”, con un rapporto di cellule sane:distrofiche di 1:9. Una volta formate le fibre muscolari (i miotubi) è stata valutata la produzione di distrofina. I risultati hanno mostrato che sia i mioblasti sia i mesoangioblasti inducono un ripristino dell’espressione della distrofina nei miotubi DMD. Ma, i mesoangioblasti mostrano un’efficienza nettamente superiore ai mioblasti: in termini numerici si ha rispettivamente un 40% di distrofina prodotta rispetto a un 15%. Per quello che riguarda la distribuzione, con la co-coltura di mesoangioblasti la distrofina è localizzata lungo tutto il miotubo. Il 40% di produzione di distrofina è un dato importante perché supera quella soglia del 30% che la comunità scientifica ritiene come necessaria per avere un effetto terapeutico.
Questo studio è molto interessante per due principali motivi: prima di tutto è decisamente innovativo ed è un apripista per l’utilizzo del metodo “trial on a chip” e della microingegneria in generale nel campo della Duchenne (un altro interessante studio per la DMD basato sulla microingegneria è quello pubblicato da Marco Quarta di cui Parent Project Onlus ha parlato qui e qui, in secondo luogo fornisce risultati favorevoli alla possibile efficacia della terapia cellulare basata sui mesoangioblasti. Un incoraggiamento quindi a proseguire su questa via, nonostante i deboli dati di efficacia riscontrati nello studio clinico, e che pone le basi per valutare e testare tutta una serie di variabili che possono influenzare ed essere determinanti per l’efficacia della terapia cellulare.
La comunità scientifica si è così dotata di un’arma in più per continuare la battaglia contro la Duchenne. I punti di forza di questo nuovo approccio “clinical trial on a chip” consistono nella sua semplicità, rapidità ed economicità per testare nuovi farmaci o strategie terapeutiche e, soprattutto, nella possibilità di dare preziose informazioni per la pianificazione dei trial sui pazienti.
Nasce il Sostegno per L’Inclusione Attiva, un sussidio per le famiglie
E’ stata attivata una misura di contrasto alla povertà, il SIA (Sostegno per l’inclusione attiva), che prevede l’erogazione di un contributo economico alle famiglie in condizioni economiche disagiate dove sono presenti persone minorenni, con disabilità o donne in stato di gravidanza accertato. L’obiettivo è quello di aiutare le famiglie a superare ed affrontare la condizione di difficoltà attraverso un progetto personalizzato di attivazione sociale o lavorativo, che coinvolge l’intero nucleo e promuove gradualmente l’autonomia. L’adesione al progetto è condizione necessaria per usufruire del contributo. Dal 2 settembre e fino al 31 ottobre è possibile recarsi presso tutti i Comuni per effettuare la domanda. I Comuni verificheranno i requisiti di accesso stabiliti dall’INPS, che provvederà all’erogazione attraverso l’attribuzione di una carta di pagamento elettronica, utilizzabile per l’acquisto dei beni di prima necessità.
I requisiti del nucleo per poter accedere al SIA nel 2016 sono i seguenti:
Requisiti familiari: presenza di almeno un componente di minore età, una persona con disabilità o una donna in stato di gravidanza accertato;
Requisiti economici: ISEE inferiore o pari a 3.000 euro
Valutazione del bisogno: effettuata dai Servizi sociali del Comune. che tiene conto. mediante una scala di valutazione multidimensionale dei carichi familiari, della situazione economica e lavorativa del nucleo.
Si terrà conto, per l’accesso al contributo, di eventuali misure di sostegno al reddito di cui beneficia il nucleo familiare.




