Summit arruola negli Stati Uniti i pazienti nello studio clinico PhaseOut DMD, il trial di fase 2 con ezutromid nei pazienti DMD
Oxford, Regno Unito, 16 novembre 2016 – Summit Therapeutics plc (NASDAQ: SMMT, AIM: SUMM), la company focalizzata sulla scoperta e sviluppo di farmaci per l'avanzamento delle terapie per la Distrofia Muscolare di Duchenne (DMD) e l'infezione da Clostridium difficile , ha annunciato oggi di aver arruolato i suoi primi pazienti presso i centri negli USA dello studio PhaseOut DMD, un trial clinico di fase 2 di tipo "proof of concept" con ezutromid nei pazienti con DMD. La somministrazione di ezutromid è prevista dopo il periodo di screening dalla durata massimo di 28 giorni. L'arruolamento e la somministrazione dei pazienti nello studio PaseOut DMD nel Regno Unito è in corso. Ezutromid è un modulatore dell'utrofina e rappresenta un potenziale trattamento per modificare la patologia per tutti i pazienti con la DMD.
"Ezutromid ha mostrato di essere promettente nei test pre-clinici come trattamento universale che ha il potenziale di rallentare o fermare la progressione della patologia in tutti i pazienti con la DMD, indipendentemente dalla loro sottostante mutazione genetica nella distrofina" ha detto John Jefferies, MD, del Cincinnati Children’s Hospital Medical Center, e coordinatore degli sperimentatori negli USA per PhaseOut DMD. "Siamo entusiasti di partecipare allo studio PhaseOut DMD e contribuire allo sviluppo clinico di questo modulatore dell'utrofina"
Ralf Rosskamp, MD, Chief Medical Officer di Summit ha aggiunto, "Il nostro studio clinico PhaseOut DMD è un elemento importante per rendere disponibile ezutromid ai pazienti e alle famiglie che hanno un urgente bisogno di una terapia per modificare la patologia e stiamo facendo progressi con l'arruolamento dei pazienti in questo studio clinico, con il reclutamento in corso nel Regno Unito e ora in USA."
Traduzione a cura dell’Ufficio Scientifico di Parent Project onlus
Parent Project alla Giornata Internazionale dei diritti dell’infanzia
 La convenzione ONU sui Diritti dell'infanzia fu approvata dall'Assemblea Generale delle Nazioni Unite il 20 novembre 1989. L’evento viene ricordato ogni anno, il 20 novembre appunto, nella Giornata internazionale per i diritti dell'infanzia e dell'adolescenza. L’Italia ha ratificato la Convenzione nel 1991. Ad essa non mancano mai di ispirarsi i pronunciamenti e gli atti dell’Europa in tema di infanzia.
La convenzione ONU sui Diritti dell'infanzia fu approvata dall'Assemblea Generale delle Nazioni Unite il 20 novembre 1989. L’evento viene ricordato ogni anno, il 20 novembre appunto, nella Giornata internazionale per i diritti dell'infanzia e dell'adolescenza. L’Italia ha ratificato la Convenzione nel 1991. Ad essa non mancano mai di ispirarsi i pronunciamenti e gli atti dell’Europa in tema di infanzia.In onore di tale evento l’Assessore alle politiche sociali del Comune di Messina, Nina Santisi, ha organizzato, dal 20 al 27 Novembre, in collaborazione con le associazioni del territorio, una settimana dedicate interamente ai bambini. Anche Parent Project darà il suo contributo: lunedì 21 Novembre, alle ore 17, verrà proposto un incontro di lettura per bambini con disabilità, in gemellaggio con la biblioteca regionale Cannizzaro, presso Piazza Unione Europea. L’obiettivo è quello di creare un'occasione stimolante che consenta ai bambini di avere un canale di comunicazione privilegiato nell’esprimere e percepire le emozioni, e andare così alla scoperta delle proprie potenziali risorse. A rendere più festosa l’atmosfera, in piazza ci saranno clown, bande musicali e una golosa merenda!
Convegno “Malattie rare al Besta – La distrofia muscolare di Duchenne e Becker”
All’Hilton Milan un appuntamento per approfondire la conoscenza della patologia genetica rara
Venerdì 2 dicembre 2016
Hilton Milan Hotel
Via Luigi Galvani, 12 – Milano
Ore 9.15
Venerdì 2 dicembre si svolgerà, presso l’Hilton Milan Hotel di Milano, il convegno “Malattie rare al Besta – La distrofia muscolare di Duchenne e Becker”, dedicato ad un approfondimento sulla distrofia muscolare di Duchenne e Becker, patologia rara che è tra le cause più frequenti di disabilità su base genetica in età pediatrica.
L’appuntamento, che è stato organizzato dall’Istituto Neurologico Carlo Besta di Milano e ha come responsabili scientifici il Dr. Giovanni Baranello, il Dr. Lorenzo Maggi e la Dr.ssa Isabella Moroni, ha la finalità di fornire una panoramica globale a pediatri e medici di medicina generale, così come a specialisti e professionisti coinvolti nella gestione dei pazienti con distrofia muscolare di Duchenne e distrofia muscolare di Becker.
I vari relatori tratteranno i vari aspetti connessi a queste patologie, dalla possibilità ed importanza di una diagnosi precoce, all’impostazione di un corretto follow up ed al monitoraggio degli aspetti clinici e funzionali, fino alle più recenti sperimentazioni cliniche.
L’evento ha ricevuto il supporto non condizionante di PTC Therapeutics e si svolge con il patrocinio di UILDM-Unione Italiana Lotta alla Distrofia Muscolare onlus, Parent Project onlus, Associazione Italiana di Miologia, Ordine Provinciale dei Medici Chirurghi e degli Odontoiatri di Milano, Alleanza Neuromuscolare, Società Italiana di Pediatria, Società Italiana di Neurologia, Fondazione Telethon e Regione Lombardia.
Nel pomeriggio è previsto un intervento delle associazioni UILDM e Parent Project onlus, che illustreranno progetti ed attività dedicati alla comunità dei pazienti.
L’evento è stato accreditato presso il Ministero della Salute per le figure di Biologo, Fisioterapista, Infermiere, Infermiere Pediatrico, Medico Chirurgo, Psicologo, Tecnico della Riabilitazione Psichiatrica, Tecnico di Neurofisiopatologia, Tecnico Sanitario di Laboratorio Biomedico, Terapista della Neuro e Psicomotricità dell’Età Evolutiva. L’iscrizione è gratuita e obbligatoria.
In allegato il Programma del Convegno
UILDM è un'organizzazione nata nel 1961 con due scopi specifici: sostenere la ricerca scientifica e l'informazione sulle distrofie e le altre malattie neuromuscolari e promuovere l'inclusione sociale delle persone con disabilità, attraverso l'abbattimento di ogni tipo di barriera. Ha una presenza capillare sul territorio e svolge un importante lavoro in ambito sociale e di assistenza medico-riabilitativa ad ampio raggio, gestendo anche centri ambulatoriali di riabilitazione, prevenzione e ricerca, in stretta collaborazione con le strutture universitarie e socio-sanitarie di base.
Parent Project onlus è un’associazione di genitori con figli affetti da distrofia muscolare di Duchenne e Becker. Dal 1996 lavora per migliorare il trattamento, la qualità della vita e le prospettive a lungo termine dei bambini e ragazzi affetti dalla patologia attraverso la ricerca, l’educazione, la formazione e la sensibilizzazione. Gli obiettivi di fondo che hanno fatto crescere l’associazione fino ad oggi sono quelli di affiancare e sostenere le famiglie attraverso una rete di Centri Ascolto, promuovere e finanziare la ricerca scientifica e sviluppare un network collaborativo in grado di condividere e diffondere informazioni chiave. www.parentproject.it
Per informazioni:
UILDM-Direzione Nazionale, via Vergerio 19, 35126 Padova – tel 049/8021001 – mail UILDMcomunicazione@uildm.it
Parent Project onlus, via Nicola Coviello, 12-14 00165 Roma – tel. 06/66182811 – mail e.poletti@parentproject.it
Per le iscrizioni
Nadirex International Srl
Tel. 0382.525714/35
info@nadirex.com
Il CHMP raccomanda il rinnovo dell’ autorizzazione alla commercializzazione di Translarna ™ per la distrofia muscolare di Duchenne causata da mutazione nonsenso sulla base di una valutazione positiva persistente del rischio-beneficio
PTC condurrà uno studio clinico post-autorizzazione -
South Plainfield, NJ, 11 novembre 2016 / PRNewswire / - PTC Therapeutics, Inc. (NASDAQ: PTCT) ha annunciato oggi che il Comitato per i Prodotti Medicinali per Uso Umano (CHMP) dell’Agenzia Europea dei Medicinali (EMA) ha raccomandato il rinnovo dell’autorizzazione condizionale alla commercializzazione di Translarna ™ (ataluren) per il trattamento della distrofia muscolare di Duchenne causata da mutazione nonsenso (nmDMD) nei pazienti deambulanti di età uguale e superiore ai cinque.
In associazione con il rinnovo, l'autorizzazione alla commercializzazione includerà l’obbligo specifico di condurre un trial supplementare a lungo termine post-autorizzazione.
"Siamo soddisfatti di questo risultato, che ha tenuto conto di tutti i dati disponibili per Translarna", ha detto Stuart W. Peltz, Ph.D., Chief Executive Officer, PTC Therapeutics, Inc. "Questa decisione riflette il beneficio che Translarna sta avendo per i pazienti che hanno una distrofia muscolare di Duchenne causata da una mutazione nonsenso".
L'opinione del CHMP costituisce la base per una decisione della Commissione Europea sul rinnovo dell'autorizzazione alla commercializzazione. La Commissione Europea generalmente esprime la propria decisione entro tre mesi.
"Translarna ha dimostrato benefici clinicamente significativi per i pazienti", ha detto Eugenio Mercuri, M.D., professore di Neurologia Pediatrica presso l'Università Cattolica, Roma, Italia. "La distrofia muscolare di Duchenne è una patologia devastante che comporta una progressiva perdita della funzionalità muscolare. Il mantenimento della funzionalità muscolare è di massima importanza per i pazienti".
"La consistenza del beneficio di Translarna mostrato negli endpoint chiave è impressionante per una terapia che mira a ripristinare la distrofina", ha detto Craig McDonald, M.D., Professore di Pediatria e presidente del Dipartimento di Medicina e Riabilitazione Fisica presso l'Università della California. "Sono felice per la comunità DMD della raccomandazione del CHMP."
Il CHMP ha chiesto che PTC conduca un nuovo studio di 18 mesi, randomizzato, controllato con placebo in pazienti con distrofia muscolare di Duchenne causata da mutazione nonsenso, come obbligo specifico di post-autorizzazione, con risultati disponibile attesi per il primo trimestre del 2021. A questo studio seguirà un periodo di estensione in aperto di 18 mesi in cui tutti i pazienti assumeranno Translarna. PTC ha proposto un trial di portata simile ad ACT DMD e i dettagli del protocollo sono attesi per essere finalizzati in future interazioni con l'EMA. Le autorizzazioni all'immissione in commercio condizionali sono sottoposte a una rivalutazione e rinnovo annuale.
"Per i ragazzi con la distrofia muscolare di Duchenne, ogni giorno è importante e la perdita funzionale non può essere recuperata. I pazienti hanno bisogno di accedere a nuove terapie innovative come Translarna", ha dichiarato Filippo Buccella, fondatore di Parent Project Italia, un’ associazione di genitori con figli affetti dalla Distrofia Muscolare di Duchenne.
Traduzione a cura dell’Ufficio Scientifico di Parent Project onlus
Actelion ottiene un’opzione per la lincenza del Vamorolone da ReveraGen
Vamorolone, un nuovo composto per il trattamento della Distrofina Muscolare di Duchenne, possiede il potenziale per preservare meglio la funzione muscolare e prolungare la deambulazione nei pazienti, in assenza di alcuni degli effetti collaterali associati con la terapia con i glucocorticoidi.
ALLSCHWIL, SWITZERLAND, e ROCKVILLE (MD), USA - 03 novembre 2016 - Actelion Ltd (SIX: ATLN) e ReveraGen BioPharma, Inc., una company privata impegnata nella scoperta e sviluppo di prodotti terapeutici di loro proprietà per patologie neuromuscolari e infiammatorie, ha annunciato oggi di aver stipulato un accordo. In base a tale accordo Actelion ha ottenuto un'opzione esclusiva per licenziare il principale composto di RiveraGen, il vamorolone, per il trattamento della Distrofia Muscolare di Duchenne in due diverse fasi del suo sviluppo.
Il Vamorolone è un nuovo composto che possiede il potenziale di preservare la funzionemuscolare e prolungare la deambulazione in assenza di alcuni degli effetti collaterali noti associati con i corticosteroidi attualmente in uso. Questo aspetto è importante specialmente per i pazienti Duchenne molto giovani in cui la terapia con i glucocorticoidi non è appropiata a causa di questi effetti collaterali che includono l'arresto della crescita e l’immuno soppressione.
Jean-Paul Clozel, MD e Chief Executive Officer di Actelion, ha commentato "Siamo stati molto impressionati dal lavoro pioneristico condotto dal Dott. Hoffman e dal suo gruppo a ReveraGen, e dall'incoraggiamento ricevuto dalla comunità di pazienti rispetto allo sviluppo del vamorolone. Attraverso le nostre consolidate competenze in ambito scientifico, regolatorio e commerciale nell'area dei farmaci orfani, Actelion è in una posizione ideale per supportare lo sviluppo di questo nuovo approccio terapeutico, a beneficio dei ragazzi affetti dalla Distrofia Muscolare di Duchenne e aiutando chi si prende cura di loro".
Eric Hoffman, Chief Executive Officer of ReveraGen, ha commentato " La Duchenne è stata al centro del nostro impegno per molti anni e ora abbiamo la possibilità di rallentare la progressione di questa devastante patologia. Il progetto ha già notevolmente beneficiato di un ampio supporto filantropico e siamo lieti dell'accordo di opzione che renderà disponibili le competenze scientifiche e commerciali di Actelion consendo al vamorolone di raggiungere rapidamente i pazienti con la Duchenne e le loro famiglie."
ReveraGen sta conducendo parallelamente lo sviluppo clinico del vamorolone sia negli USA che in Europa. Alla fine del 2015 è stato completato un trial clinico di fase 1 supportato attraverso contratti di venture philanthropy da organizzazioni tra le quali Muscular Dystrophy Association (USA), Joining Jack (UK), Duchenne Research Fund (UK) e Duchenne Children's Trust (UK).
Uno studio di fase 2a è attualmente in corso e mira a verificare la sicurezza ed efficacia del vamorolone in bambini Duchenne tra i 4 e i 7 anni che non assumono steroidi ( pazienti che non hanno assunto prednisone o deflazacort). Il programma clinico nella DMD viene sviluppato e condotto attraverso mediante la collaborazione tra il gruppo CINRG e l’Università di Newcastle (Kate Bushby e Michela Guglieri). Un programma di fase 2 b è in fase di progettazione.
Traduzione a cura dell’Ufficio Scientifico di Parent Project Onlus
cTAP annuncia la pubblicazione di due ricerche che classificano e predicono la progressione della patologia nella Distrofia Muscolare di Duchenne
31 ottobre 2016
CAMBRIDGE, Mass.--(BUSINESS WIRE)—La “Collaborative Trajectory Analysis Project” (cTAP), una partnership pubblico-privato per accelerare la definizione di soluzioni attraverso dati scientifici a problematiche critiche nello sviluppo di farmaci per la Distrofia Muscolare di Duchenne (DMD), ha annunciato oggi la pubblicazione di due studi che hanno importanti implicazioni nella progettazione di trial clinici efficaci.
Tutti i pazienti Duchenne con il tempo perdono la capacità di deambulare ma la velocità di declino della funzionalità deambulatoria può variare ampiamente tra i diversi pazienti. Questa variabilità può rendere poco chiara l’interpretazione degli studi clinici rendendo difficile discernere se un farmaco è efficace o meno. Gli studi pubblicati in questione spiegano circa metà della variabilità che si ha nella progressione della patologia nella Duchenne, e lo fanno più del doppio di quanto spiegato in precedenza con le analisi convenzionali.
"Senza questa comprensione della naturale progressione clinica per le diverse cause genetiche della DMD, sarebbe estremamente difficile disegnare gli studi clinici o selezionare gli obiettivi appropriati necessari per sviluppare nuovi farmaci da usare per la DMD," ha detto Dr.Edward Kaye, Presidente, CEO e Chief Medical Officier di Sarepta Therapeutis. " cTAP è uno dei migliori esempi di collaborazione accademica internazionale che ha consentito un avanzamento nella comprensione clinica della Distrofia Muscolare di Duchenne."
cTAP ha messo insieme i principali esperti clinici nella Duchenne, gli sviluppatori di farmaci e gli esperti analitici con l’obiettivo comune di migliorare gli studi clinici nella Duchenne apprendendo dai dati dei pazienti. I due studi pubblicati hanno impiegato metodi statistici per quantificare e predire la progressione della patologia nella Duchenne, attingendo da un database in crescita con più di 1000 ragazzi Duchenne che, in totale, comprende valutazioni funzionali condotte in più di 10.000 visite cliniche.
Il professor Eugenio Mercuri, dell ’Unità Operativa di Neuropsichiatria Infantile presso l'Università Cattolica del Sacro Cuore di Roma, è uno dei maggiori esperti nel mondo nella Duchenne e ha aperto la strada all'accesso collaborativo ai dati del registro sulla Duchenne che hanno reso possibili questi studi. "Come primo passo, abbiamo voluto quantificare le diverse velocità di progressione della patologia nei diversi pazienti," ha detto Mercuri. Pubblicato sul numero di Settembre della rivista Neuromuscolar Disorders, lo studio di Mercuri e dei suoi colleghi ha identificato gruppi di pazienti statisticamente distinti che avevano traiettorie simili per quel che riguarda la funzionalità deambulatoria nel tempo; la classificazione dei pazienti in questi gruppi spiega più della metà della variabilità nelle traiettorie di progressione della patologia.
Basandosi su questi risultati, un secondo studio guidato dalla professoressa Nathalie Goemans, esperta nel campo della Duchenne e a capo del Neuromuscular Reference Center for Children presso la University Hospital a Leuven in Belgio, è stato pubblicato nel volume 18 di ottobre della rivista PLoS One. Goemans e i suoi colleghi hanno sviluppato un modello per la previsione dei cambiamenti in un anno della funzionalità deambulatoria, usando le caratteristiche dei pazienti e le misure funzionali. Il modello predittivo spiega più del doppio della variabilità che si ha negli esiti deambulatori rispetto alle misurazioni sui pazienti utilizzate per definire l’elegibilità per gli studi clinici nella Duchenne.
Entrambi gli studi sono stati condotti attraverso cTAP e con la collaborazione scientifica del Dott. James Signorovitch, Vice Presidente e ricercatore esperto nelle outcome, e di un team di ricercatori e scienziati presso la Analysis Group Inc.
Finanziamenti
La raccolta e la gestione dei dati dei pazienti è stata supportata in Italia attraverso il finanziamento della Fonazione Telethon e di Parent Project Onlus, e in Belgio dal Fonds Spierzieke Kinderen. I fondi per condurre le analisi biostatistiche presso la Analysis Group Inc. sono stati ottenuti attraverso il contributo delle aziende biofarmaceutiche sponsor - Pfizer, Shire, Biomarin, Sarepta, PTC Therapeutics, Solid Bioscience, Catabasis e BMS. Le associazioni di pazienti, Cure Duchenne e Parent Project Muscular Dystrophy, hanno fornito il supporto per la Dott.ssa Susan J. Ward, Direttore Esecutivo di cTAP, per gestire la collaborazione.
Lavori citati
PLoS One, 2016, 0164684; doi: 10.371/journal.pone.0164684
Individualized prediction of changes in 6-minute walk distance for patients with Duchenne muscular dystrophy. Nathalie Goemans, Marleen vanden Hauwe, James Signorovitch, Elyse Swallow, Jinlin Song, for the Collaborative Trajectory Analysis Project (cTAP). http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0164684
Neuromuscular Disorders 26 (2016) 576–583. doi:19.1016.j.nmd.2016.05.016
Categorizing natural history trajectories of ambulatory function measured by the 6-minute walk distance in patients with Duchenne muscular dystrophy. Eugenio Mercuri, James Edward Signorovitch, Elyse Swallow, Jinlin Song and Susan J. Ward for the Collaborative Trajectory Analysis Project (cTAP) and the DMD Italian group.
La Distrofia Muscolare di Duchenne
La Duchenne è una patologia fatale che comporta una degenerazione progressiva dei muscoli e che colpisce circa 1 ogni 3500-6000 nati maschi. I pazienti non hanno la capacità di produrre la distrofina, una proteina cruciale per la funzione dei muscoli. A causa della degenerazione nei muscoli i pazienti perdono progressivamente la capacità di camminare, di alimentarsi, di girarsi nel letto e infine di respirare. Nonostante non ci sia una cura, nell'ultimo decennio c'è stata un'esplosione nel campo della ricerca che ha permesso a 15 o più terapie di entrare in fase di sviluppo clinico. Gli studi clinici sono stati difficili da progettare e hanno portato a importanti iniziative che potrebbero migliorare il disegno e l'interpretazione degli studi.
http://www.cureduchenne.org;
http://www.parentprojectmg.org
cTAP
cTAP sta consentendo ai principali esperti clinici di risolvere le problematiche più critiche nel campo dello sviluppo di farmaci per la Duchenne. cTAP, una partnership pubblico-privata prima nel suo genere nella Duchenne, ha forgiato un'alleanza dinamica tra esperti clinici, aziende farmaceutiche che stanno sviluppando terapie, associazioni di pazienti e network di registri e centri clinici per la Distrofia Muscolare di Duchenne in Europa e negli USA, insieme a esperti in campo dati per la ricerca sulle valutazioni della salute. Gestendo il più grande, e ancora in crescita, database clinico sulla storia naturale, cTAP sviluppa soluzioni attraverso l'applicazione della scienza avanzata dei dati focalizzata sui requisiti e sull'urgenza necessari ad avere un impatto a breve termine sul disegno e sull'analisi degli studi clinici.
Il Gruppo di Analisi
Con oltre 700 professionisti, molti dei quali con competenze ad alto livello nell’ambito della ricerca sulle valutazioni della salute, in epidemiologia, strategia, biostatistica, economia e altre discipline quantitative, il Gruppo di Analisi ha rivestito un ruolo primario nella scienza, economia e strategie d’impresa dell’industria mondiale sanitaria. Gli undici uffici aziendali sono presenti negli USA a Boston, Chicago, Dallas, Denver, Los Angeles, Menlo Park, New York, San Francisco, e Washington, D.C. e a Montreal e Pechino a livello internazionale.
Traduzione a cura dell’Ufficio Scientifico di Parent Project Onlus
XV International Conference on Duchenne and Becker Muscular Dystrophy
XV International Conference on Duchenne and Becker Muscular Dystrophy
Ergife Palace Hotel, Rome
February 18 - 19, 2017
Parent Project onlus annual conference is a unique convergence of people living with Duchenne and their families, industry partners, scientific leaders, medical providers.
Nearly 600 families from Italy and the world gather to learn about the latest progress in the fight to end Duchenne. They also join together for gaining support and strength from other patients and families. Our annual conference is an opportunity for Duchenne community to dialogue face-to-face about the disease. These discussions open communication channels, lay the groundwork for future collaborations and shape our understanding of the Duchenne landscape.
This event is realized under the High Patronage of the European Parliament.

Download the draft agenda
Info and registrations:
Nicoletta Madia
n.madia@parentproject.it
+39 06/66182811
Sulle strade del Giro d’Italia contro la Distrofia Muscolare di Duchenne.
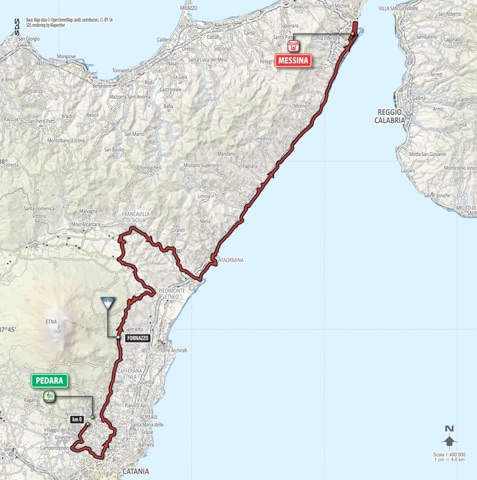 Maurizio Guanta e Valerio Capsoni, con il supporto di Marcello Marina e Cinelli, pedaleranno Domenica 6 Novembre 2016 lungo il percorso della Quinta Tappa del Giro d’Italia 2017, nella sua edizione del Centenario, da Pedara, alle pendici dell’Etna, fino a Messina, città dello Stretto. 157 i km per testimoniare la lotta alla Duchenne, attraverso i paesi pedemontani etnei, la valle dell’Alcantara e la costa jonica messinese. Tutti gli appassionati che volessero unirsi anche solo per parte del percorso saranno i benvenuti.
Maurizio Guanta e Valerio Capsoni, con il supporto di Marcello Marina e Cinelli, pedaleranno Domenica 6 Novembre 2016 lungo il percorso della Quinta Tappa del Giro d’Italia 2017, nella sua edizione del Centenario, da Pedara, alle pendici dell’Etna, fino a Messina, città dello Stretto. 157 i km per testimoniare la lotta alla Duchenne, attraverso i paesi pedemontani etnei, la valle dell’Alcantara e la costa jonica messinese. Tutti gli appassionati che volessero unirsi anche solo per parte del percorso saranno i benvenuti.
20 ANNI DI NEUROPSICHIATRIA INFANTILE AL POLICLINICO UNIVERSITARIO A.GEMELLI
Si terrà il 4 novembre presso l'Aula Brasca del Policlinico Universitario A.Gemelli la celebrazione dei 20 anni del reparto di Neuropsichiatria Infantile.
In particolare, la sessione pomeridiana a partire dalle ore 16.30, sarà dedicata alle malattie neuromuscolari e interverranno il Prof. Victor Dubowitz con una panoramica sulle malattie neuromuscolari infantili, la Dott.ssa Marika Pane sul Centro Nemo e concluderà il Prof. Eugenio Mercuri sui trial clinici.
Prima della conclusione di questo importante evento un contributo da parte delle organizzazioni di pazienti Parent Project onlus, Famiglie Sma onlus e Asamsi.


