"In viaggio con Luca" vince il Premio OMaR per la migliore campagna di comunicazione
Condividiamo con gioia la notizia che la campagna "In viaggio con Luca" di Parent Project onlus - svoltasi dal 18 novembre al 2 dicembre 2018 - ha ricevuto il Premio per la migliore campagna di comunicazione all'interno della VI edizione del Premio OMaRper la comunicazione sulle malattie e i tumori rari organizzata dall’Osservatorio Malattie Rare, in partnership con il Centro Nazionale Malattie Rare dell’ISS, Orphanet, Fondazione Telethon e Uniamo FIMR Onlus.
La premiazione si è svolta ieri, 28 febbraio, a Roma, nella suggestiva cornice dell’Ara Pacis, in occasione della Giornata mondiale sulle Malattie Rare, ed ha visto la partecipazione di oltre 200 persone.
E' possibile rivedere la serata della premiazione - alla quale hanno partecipato per ritirare il premio Luca e Giacomo Buccella e Roberto Zoffoli, protagonisti del nostro spot - sulla pagina Facebook di OMaR: https://www.facebook.com/malattierareOmar/
Di seguito il comunicato diffuso da OMaR,
COMUNICATO STAMPA
MALATTIE RARE: AL VI PREMIO OMAR VINCONO LE TERAPIE AVANZATE E UNA NUOVA VISIONE DELLE PERSONE CON MALATTIE RARE
- Sul podio Adriana Bazzi del Corriere della Sera, Barbara Di Chiara di Adnkronos, Emilia Vaccaro di Pharmastar, Cristina Tognaccini di AboutPharma, il fotografo Stefano Scherma, le Associazioni Parent Project Onlus e Prader Willi Campania. Ad Anna Meldolesi va il Premio Eugenio Aringhieri.
Roma, 1 marzo 2019 – Si è chiusa la VI edizione del Premio OMaR per la comunicazione sulle malattie e i tumori rari organizzata dall’Osservatorio Malattie Rare, in partnership con il Centro Nazionale Malattie Rare dell’ISS, Orphanet, Fondazione Telethon e Uniamo FIMR Onlus. L’evento si è svolto a Roma, nella suggestiva cornice dell’Ara Pacis, in occasione della giornata mondiale, ed ha visto la partecipazione di oltre 200 persone.
“Come ogni anno, abbiamo provato ad introdurre delle novità e dei miglioramenti - ha dichiarato Ilaria Ciancaleoni Bartoli, direttore dell’Osservatorio Malattie Rare - ln primo luogo, abbiamo coinvolto nei lavori della giuria delle diverse professionalità, attivando partnership con FERPI, Ability channel e con il Festival Uno sguardo raro. Inoltre abbiamo voluto premiare non solo la parte di comunicazione che emerge, quella che tutti possono vedere, ma anche quel lavoro più nascosto ma altrettanto importante che è svolto dalle agenzie di stampa e dalla stampa specializzata. Infine abbiamo voluto dedicare un premio speciale ad una persona che ha lasciato un segno importante nel mondo del farmaco e in particolare delle malattie rare: Eugenio Aringhieri, manager visionario ed appassionato prematuramente scomparso”.
Sei premi, più una menzione e un premio speciale, assegnati dalla giuria a chi è stato in grado di affrontare correttamente il tema delle terapie avanzate, trasmettendo un messaggio di positività che non induce però a false speranze. Allo stesso modo, i giurati hanno dato le proprie preferenze a chi che si è dimostrato capace di rompere gli schemi della comunicazione dando una visione diversa della comunità dei malati rari. Non da ultimo, il premio di quest’anno offre un’attenzione speciale al lavoro dellastampa specializzata e alle agenzie di stampa, che spesso lavorano dietro le quinte e che invece rappresentano una fonte preziosa d’informazione per molti comunicatori.
I vincitori della VI Edizione del Premio OMaR
Adriana Bazzi, Il Corriere della Sera con l’articolo “Taglia & Cuci del DNA. Purché nelle mani giuste” (Premio Giornalistico Categoria Stampa e Web) per il rigore con il quale ha raccontato lo stato dell’arte di alcune nuove tecniche che stanno alla base degli approcci terapeutici sperimentali più avanzati, come il genome editing.
Emilia Vaccaro, Pharmastar “B-Side” (Premio giornalistico categoria audio video) riesce a comunicare l’emofilia con un linguaggio semplice e originale senza sminuire le implicazioni di una patologia cronica e rara.
Barbara Di Chiara, Adnkronos “Storia di Chiara, la febbre mediterranea mi ha tolto l’infanzia” (Premio della giuria) da una parte rappresenta il riconoscimento della professionalità con cui ha raccontato una rara malattia genetica, la febbre mediterranea familiare, ma anche il valore simbolico dell’impegno delle agenzie di stampa nel diffondere in modo puntuale e rigoroso informazioni scientifiche.
Cristina Tognaccini, AboutPharma “Speranze da terapia genica e oligonucleotidi antisenso” (Menzione speciale) valorizza un articolo di grande valore comunicativo perché capace di coniugare una grande capacità espressiva e divulgativa ad una ineccepibile correttezza dell’informazione. La menzione ha anche il significato simbolico di dare visibilità e gratificazione al prezioso lavoro svolto costantemente della stampa specializzata.
Parent Project Onlus “In viaggio con Luca” (Premio per la migliore campagna di comunicazione) colpisce FERPI per la capacità di rovesciare i cliché sulle malattie rare e per la serenità trasmessa dal protagonista Luca, colpito dalla malattia.
Stefano Scherma “Faire Avec” (Premio per la migliore divulgazione attraverso foto, illustrazioni o fumetti) giudicato da Michelangelo Gratton di Ability Channel, piace per le immagini conducono l’osservatore all’interno della quotidianità del paziente con malattia rara, senza note di pietismo né compassione, ma valorizzando la bellezza dei piccoli e inconsapevoli gesti della vita di ogni giorno.
Associazione Sindrome di Prader Willi Campania “Ciak! Molto bene!” (Premio per la migliore divulgazione attraverso video) colpisce la giuria del Festival Uno Sguardo Raro per la capacità di rappresentare in maniera inedita e originale la reazione umana di fronte ad una malattia rara e sconosciuta che arriva in famiglia.
Anna Meldolesi, Blog CRISPeR MANIA (Premio Eugenio Aringhieri) si è distinta per aver portato all’attenzione di un pubblico ampio il tema dell’editing genomico attraverso il Blog CRISPeR MANIA https://crispr.blog/ e le iniziative collegate, tra le quali un libro ‘E l’uomo creò l’uomo’ di straordinaria capacità divulgativa e scorrevolezza nonostante la tematica complessa.
Eventuali aggiornamenti saranno comunicati attraverso Osservatorio Malattie Rare e nel sito dedicato www.premiomalattierare.it.
ll Premio Omar ha ricevuto quest’anno il patrocinio di Eurordis, Alleanza Malattie Rare, Ability Channel, Festival Uno Sguardo Raro, Centro Documentazione Giornalistica, Comunicazione Pubblica, Consiglio Nazionale Ricerche (CNR), Federazione Italiana Editori Giornali (FIEG), Federazione Nazionale Stampa Italiana (FNSI), Federazione Relazioni Pubbliche Italiana (FERPI), Ordine Nazionale dei Giornalisti (ODG), Unione stampa periodica Italiana (USPI) e Whin (Web Health Information Network).
In questa edizione sono presenti diversi sponsor che hanno sostenuto l’iniziativa: Biogen; C4T; Sobi; Amicus; Sanofi genzyme; Shire Italia Spa ora parte di Takeda; Chiesi; Baxter; Pfizer; Roche; Aegerion; Alnylam; Akcea; APR; Celgene; Grifols; Kyowa Kirin; Merck Serono; PTC Therapeutics; Sarepta; Vertex.
O.Ma.R. - Osservatorio Malattie Rare
www.osservatoriomalattierare.
info@osservatoriomalattierare.
P.IVA: 02991370541
Sede Legale: Via Varese, 46 - 00185 Roma
Direttore Responsabile: Ilaria Ciancaleoni Bartoli
In arrivo a San Bellino “Insieme X fermare la Duchenne”
Un appuntamento per sostenere la ricerca sulla distrofia muscolare di Duchenne e Becker
Domenica 24 marzo 2019
Iscrizioni a partire dalle 7.45 – partenza alle 8.45
Ritrovo presso gli Impianti Sportivi di via Codosa, 134
San Bellino (RO)
Il gruppo “Maistrachi x Davide” organizza, domenica 24 marzo 2019, “Insieme X fermare la Duchenne” (V Memorial Massimo Rossi): una manifestazione ciclistica ed una camminata aperte a tutti, a sostegno di Parent Project onlus.
L’evento si inserisce all’interno del calendario del Dys-Trophy Tour, il circuito di gare/ciclo-turistiche in mountain bike che ha come scopo il sostegno a Parent Project onlus, per supportare la ricerca scientifica su questa patologia genetica rara.
Domenica 24 marzo i partecipanti potranno scegliere tra un percorso di circa 60 km in bici da strada, un percorso di 35 km in mountain bike su strade sterrate, una camminata di 6, 14 o 28 km oppure, ancora, un duathlon di 20 km in bici più 6 di corsa. Le prime due opzioni richiedono il tesseramento.
La partenza sarà per tutti alle 8.45, la premiazione inizierà alle 11.30 e la manifestazione si chiuderà alle 12. La quota di partecipazione prevista è di 5 euro e verrà interamente devoluta a Parent Project.
Per informazioni e prenotazioni:
Per i percorsi in bicicletta: Massimo 348/2501503 – Ermanno 347/7793674.
Per la camminata: Riccardo 328/8634620.
www.parentproject.it
www.dystrophytour.it
28 febbraio: Giornata delle Malattie Rare
Parent Project aderisce alla Giornata delle Malattie Rare, che si celebra il 28 febbraio: un momento importante di informazione e sensibilizzazione su tutte le patologie rare, promosso da UNIAMO F.I.M.R. Onlus.
In occasione di questa ricorrenza verranno organizzati appuntamenti informativi e di sensibilizzazione in tutta Italia.
Consulta il programma degli appuntamenti: http://www.uniamo.org/wp-content/uploads/2019/02/EVENTI-ITALIA_RDD19-10.pdf
Guarda il video ufficiale della Giornata: https://bit.ly/2SfVjWK
Guarda i video internazionali della Giornata, con le testimonianze di persone che in varie parti del mondo convivono con una malattia rara:
https://www.rarediseaseday.org/videos
«Noi famiglie ci aspettiamo tanto dalla ricerca scientifica e ci impegniamo a finanziarla ed orientarla al meglio tramite Parent Project, sia per i nostri figli che per i figli che verranno, e nell'attesa mettiamo al centro la “vita” oltre la “malattia”, la vita nella quale possiamo e dobbiamo fare tanto» dichiara Luca Genovese, Presidente della onlus. «La nostra associazione, in questa particolare giornata, vuole ricordare l’importanza dell’impegno a supporto delle famiglie che convivono con una grave malattia rara.»
Recentemente la XVII Conferenza Internazionale di Parent Project, tenutasi a Roma dal 15 al 17 febbraio, ha visto l’avvicendarsi di aggiornamenti medico-scientifici sulla distrofia muscolare di Duchenne e Becker e di spazi dedicati, in modo più trasversale, alla sfera sociale ed alla vita quotidiana, attraverso sessioni parallele e tavole rotonde che hanno toccato molti temi, dalla fisioterapia all’accessibilità, passando per l’integrazione scolastica e i diritti del paziente e dei suoi familiari.
Per i giovani pazienti e i loro genitori, infatti, la dimensione della ricerca, che Parent Project contribuisce a sostenere, è fondamentale, ma altrettanto importante è operare nella quotidianità per dare a bambini e ragazzi un presente di qualità. Attraverso la rete dei Centri Ascolto Duchenne, presenti in numerose regioni italiane, l’associazione si propone di affiancare a tutto tondo le famiglie, aiutandole anche ad ottimizzare la loro rete di supporto e il loro accesso a servizi ed opportunità nei loro territori.
Negli ultimi anni il panorama della ricerca e sviluppo di farmaci per la DMD e BMD ha continuato ad evolversi: alcuni studi si trovano nelle prime fasi di sperimentazione, altri nelle fasi finali, e altri ancora addirittura in fase di post-autorizzazione all’immissione in commercio. In Conferenza sono state illustrate le strategie più innovative e specifiche, che mirano a fornire ai pazienti la distrofina (la proteina la cui assenza o deficit è alla base dell’insorgenza della distrofia muscolare di Duchenne e Becker) o a correggere le mutazioni genetiche, ma anche le strategie più universali che puntano a combattere l’infiammazione e la degenerazione del tessuto muscolare, compresi i muscoli respiratori ed il cuore, che caratterizzano la DMD e la BMD. A destare particolare interesse è stata la sessione dedicata a terapia genica, terapia cellulare ed editing genomico: strategie innovative verso le quali sono alte le speranze e le aspettative della comunità Duchenne e Becker internazionale.
Per chi desidera dare il proprio sostegno a Parent Project, sono molte le opportunità tutto l’anno. Per chi vive a Roma, è previsto un appuntamento lunedì 4 marzo presso Eataly Roma con l’iniziativa “Facciamo cose buone”, legata alla Giornata delle Malattie Rare: dalle 19 alle 23, chi cenerà al Ristorante pasta e pizza potrà scegliere un piatto speciale dedicato all’associazione, alla quale verrà devoluta una percentuale del ricavato.
Lo studio SYROS di Santhera mostra l’efficacia a lungo termine di idebenone nel rallentare la perdita della funzionalità respiratoria in pazienti con distrofia muscolare di Duchenne
L’azienda farmaceutica Santhera ha annunciato i risultati dello studio SYROS con idebenone, dimostrando che gli stessi effetti di rallentamento del declino della funzionalità respiratoria riscontrati con lo studio DELOS, condotto per 52 settimane, sono mantenuti in un contesto di vita reale per un periodo di tempo di trattamento fino a 6 anni. I risultati sono stati presentati durante la XVII Conferenza Internazionale sulla distrofia muscolare di Duchenne e Becker.
L’azienda Santhera Pharmaceutics annuncia i risultati dello studio SYROS che dimostrano come il trattamento a lungo termine con idebenone riduca in maniera sostanziale il tasso di perdita di funzionalità respiratoria in pazienti con distrofia muscolare di Duchenne per un periodo di tempo fino a 6 anni in un contesto di vita reale.
Lo studio SYROS è stato disegnato come una raccolta prospettica di dati di vita reale a lungo termine, retrospettivi, raccolti da pazienti che hanno completato la fase III positiva del trial DELOS (18 su 64) e che sono stati successivamente sottoposti a trattamento con idebenone (900mg/giorno) per un periodo medio di 4.2 anni (variabile da 2.4 a 6.1 anni) con i Programmi di Accesso Allargato (Expanded Access Programs - EAPs). L’obiettivo principale di questo studio è stato quello di valutare l’evoluzione a lungo termine della funzione respiratoria in pazienti che sono rimasti in trattamento con idebenone fino a 6 anni rispetto al loro periodo precedente senza idebenone.
I risultati di questi studio, che sono in accordo con i risultati dello studio pilota DELOS, hanno dimostrato che:
- Il trattamento mantenuto a lungo termine con idebenone ha ridotto il tasso annuale di declino della capacità vitale forzata predetta percentuale (FVC%p) del 50%.
- Gli effetti del trattamento sono mantenuti anno dopo anno fino a 6 anni.
- Queste conclusioni sono ulteriormente sostenute da riduzioni consistenti del tasso di perdita di funzione respiratoria sia inspiratoria che espiratoria per lo stesso periodo.
- Il trattamento prolungato con idebenone ha inoltre ridotto il rischio di importanti eventi clinici rilevanti per il paziente, inclusi eventi broncopolmonari avversi e ospedalizzazioni dovute a problematiche respiratorie.
"Siamo entusiasti di vedere che gli effetti significativi del trattamento con idebenone osservati nel nostro studio DELOS di fase III per 52 settimane vengono mantenuti a lungo termine", ha detto Kristina Sjöblom Nygren, MD, Chief Medical Officer e Capo dello Sviluppo di Santhera. "Le nuove indicazioni sono di grosso rilievo per i pazienti DMD in declino respiratorio che hanno urgente bisogno di una terapia che modifichi il corso del declino della funzionalità respiratoria e che ritardi in maniera sostanziale la necessità di una ventilazione assistita."
I risultati dello studio SYROS sono stati presentati durante la Conferenza Internazionale di Parent Project il 16 febbraio 2019, saranno presentati alla MDA Clinical & Scientific Conference (13-17 aprile, 2019, a Orlando) e verranno sottomessi per una pubblicazione scientifica internazionale.
A cura dell’Ufficio Scientifico Parent Project onlus
Potete rivedere la diretta streaming della Conferenza Internazionale di Parent Project dove sono stati presentati i risultati dello studio SYROS andando su questo link, a partire dal tempo 1:58:00.
Potete leggere il comunicato stampa originale diffuso da Santhera al seguente link.
Per ulteriori informazioni sullo studio clinico con idebenone potete consultare la Brochure dei Trial Clinici di Parent Project.
Sarepta Therapeutics annuncia l’accettazione della richiesta di approvazione per un nuovo farmaco (New Drug Application - NDA) di golodirsen (SRP-4053) in pazienti Duchenne trattabili con lo skipping dell’esone 53
L’azienda statunitense Sarepta Therapeutics ha ottenuto l’accettazione della richiesta per un nuovo farmaco, tecnicamente NDA, per ottenere l’approvazione accelerata di SRP-4053 (golodirsen) nei pazienti con la distrofia muscolare di Duchenne trattabili con lo skipping dell’esone 53. Sarepta ha completato la sua NDA entro la fine del 2018 come parte di una sottomissione progressiva (rolling submission) e ha richiesto alla FDA la revisione prioritaria di golodirsen che è stata concessa.
CAMBRIDGE, Mass., 14 febbraio 2019 (GLOBE NEWSWIRE) – Sarepta Therapeutics, Inc. (NASDAQ: SRPT) un’azienda biofarmaceutica in fase commerciale focalizzata sulla scoperta e sviluppo di medicinali genetici di precisione per il trattamento di patologie neuromuscolari rare, ha annunciato che la Divisione dei Prodotti Neurologici della FDA (Food and Drug Administration), ha accettato la richiesta di approvazione per un nuovo farmaco (New Drug Application - NDA) per ottenere l’approvazione accelerata per golodirsen (SRP-4053) fornendo come data di intervento regolatorio il 19 Agosto 2019. Golodirsen è un oligonucleotide antisenso che impiega un morfolino fosforodiamidato (PMO). La molecola è stata sviluppata da Sarepta Therapeutics per indurre lo skipping dell’esone 53 del gene della distrofina. La distrofia muscolare di Duchenne è una patologia genetica neuromuscolare che colpisce circa uno su 3.500 – 5.000 maschi nati in tutto il mondo.
La biotech ha completato la sua NDA alla fine del 2018 come parte di una “rolling submission” (una procedura particolare dove la FDA revisiona i singoli dossier man mano che vengono consegnati piuttosto che valutare la richiesta complessiva in un’unica volta) e ha richiesto una revisione prioritaria che è stata concessa. L’azienda ha precedentemente ricevuto la designazione di farmaco orfano per golodirsen. La NDA include i dati dello studio 4053-101 che valutano la sicurezza, la tollerabilità, la farmacocinetica e l'espressione di distrofina di golodirsen in 25 ragazzi con delezioni confermate del gene della distrofina trattabili con lo skipping dell’esone 53. Lo studio ha mostrato risultati statisticamente significativi a favore di golodirsen su tutti gli endpoint biologici, compresi la verifica dello skipping sul trascritto di RNA, l’aumento della quantità di espressione di distrofina dal livello basale e l’aumento dell'intensità della distrofina misurata mediante immunoistochimica.
"Se approvato, golodirsen sarà utile per l’8% dei pazienti della comunità Duchenne, aiutando quanti più pazienti Duchenne possibile", ha detto Doug Ingram, presidente e CEO di Sarepta. "Non vediamo l'ora di lavorare con la FDA per far progredire questa importante terapia e portarla rapidamente a pazienti Duchenne trattabili con lo skipping dell’esone 53".
Golodirsen è anche in fase di studio nel trial clinico ESSENCE (4045-301) di Sarepta, uno studio globale, randomizzato in doppio cieco, controllato con placebo, che valuta la sicurezza e l'efficacia di golodirsen e casimersen, la molecola per lo skipping dell'esone 45. La Divisione di Neurologia della FDA ha precedentemente confermato che lo studio ESSENCE potrebbe eventualmente servire come studio di conferma post-marketing.
A cura dell’Ufficio Scientifico Parent Project onlus
Potete leggere il comunicato stampa originale diffuso da Sarepta Therapeutics al seguente link.
Potete leggere la notizia sulla sottomissione della richiesta - NDA per l’approvazione accelerata di golodirsen diffusa da Sarepta Therapeutics a fine 2018 al seguente link
Per ulteriori informazioni sullo studio clinico con golodirsen potete consultare la Brochure dei Trial Clinici di Parent Project.
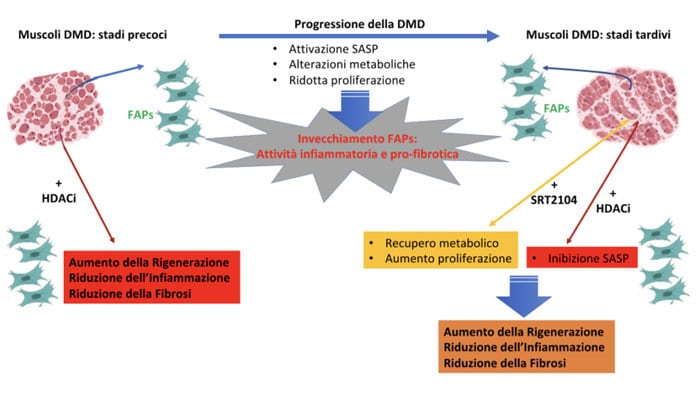
Riprogrammazione Metabolica: Una Nuova Strategia Terapeutica Per La Distrofia Muscolare Di Duchenne
Il progetto di ricerca ha lo scopo di valutare il potenziale terapeutico di una nuova strategia farmacologica che combina due molecole, un inibitore delle deacetilasi (givinostat) con un attivatore della Sirtuina1 (Sirt1), per contrastare l’avanzamento della Duchenne.
Studi precedenti hanno dimostrato la capacità degli inibitori delle deacetilasi (HDACi) di contrastare la progressione della Duchenne aumentando il potenziale rigenerativo dei muscoli distrofici. Givinostat è attualmente in studio clinico per la DMD (trial di fase3) e per la BMD (trial di fase2).
Tuttavia, l’efficacia degli HDACi è limitata agli stadi precoci della patologia, precludendo ai pazienti in fasi avanzate della DMD la possibilità di trattamento. Il gruppo di ricerca della Dottoressa Consalvi ha ipotizzato che il trattamento combinato di HDACi con attivatori della Sirt1 possa potenziare ed estendere temporalmente la loro efficacia funzionale. L’attivatore della Sirtuina1 – SRT2104 – è già utilizzato in studi clinici per il trattamento della psoriasi.
Alcuni studi, effettuati su modelli animali, hanno mostrato che diete basate sulla restrizione calorica o supplementate con resveratrolo (un polifenolo che si trova in diversi vegetali) conferiscono, attraverso l’attivazione di Sirt1, effetti metabolici benefici per il trattamento della DMD. In particolare, la stimolazione di Sirt1 contrasta molteplici difetti bioenergetici che insorgono durante la progressione della patologia e che potrebbero prevenire l’azione terapeutica degli HDACi. Verrà quindi valutato il potenziale terapeutico di SRT2104 in fasi precoci e tardive della Duchenne e in somministrazione singola o combinata con gli HDACi.
Gli esperimenti saranno condotti su topi mdx, il topo modello per la DMD, e su cellule murine e umane. In particolare, la strategia verrà testata sulle FAP, i progenitori fibroadipogenici, prelevate da topi mdx o da pazienti Duchenne. Le FAP sono delle cellule che si trovano negli interstizi del tessuto muscolare che hanno una doppia funzione: da una parte quella di formare il tessuto fibrotico e adiposo e dall’altra quella di promuovere l’azione delle cellule staminali del muscolo (le cellule satelliti) nel processo di riparazione e rigenerazione del tessuto muscolare. L’idea è quindi di valutare se la combinazione delle due molecole possa stimolare la “azione pro-rigenerativa” delle FAP e prevenirne quella pro-fibrotica, anche in condizioni in cui la patologia è in uno stadio più avanzato.
Questo progetto rappresenta il primo tentativo di combinare HDACi con altri farmaci. È importante sottolineare che la sicurezza e la tollerabilità di SRT2104 sono già state dimostrate in studi clinici sull’uomo per altre patologie (psoriasi). Questo è determinante per le potenzialità traslazionali, il passaggio allo sviluppo clinico, della strategia che potrebbe rappresentare una nuova prospettiva di trattamento per pazienti Duchenne in stadi più avanzati della patologia.
In arrivo da Eataly Roma “Facciamo cose buone” per combattere la distrofia
Un appuntamento per sostenere Parent Project onlus
Lunedì 4 marzo 2019
Eataly Roma – piazzale 14 ottobre 1492
Dalle 19 alle 23
Lunedì 4 marzo, presso Eataly Roma, si terrà una nuova edizione dell’iniziativa “Facciamo cose buone”, a sostegno di Parent Project onlus, l’associazione di pazienti e genitori di bambini e ragazzi con la distrofia muscolare di Duchenne e Becker, grave malattia genetica rara che non ha ancora una cura.
Ogni mese Eataly Roma offre al suo pubblico l’opportunità di unire il piacere del palato alla possibilità di contribuire ad una causa solidale.
Al Ristorante pasta e pizza verrà proposto un piatto speciale dedicato all’associazione: una percentuale del ricavato verrà devoluto a Parent Project onlus, per il sostegno alla ricerca ed alle attività di affiancamento delle famiglie. Il piatto della serata sarà un primo molto speciale: ravioli di baccalà con pomodorino infornato e pane aromatico.
L’iniziativa si inserisce nell’ambito della Giornata delle Malattie Rare, arrivata alla dodicesima edizione, che si celebra il 28 febbraio: un momento importante di informazione e sensibilizzazione su tutte le patologie rare. Parent Project aderisce alla Giornata promossa da UNIAMO F.I.M.R. Onlus, federazione delle associazioni di pazienti affetti da malattie rare e Alleanza Nazionale Italiana di EURORDIS, European Organisation for Rare Disease.
Saranno presenti rappresentanti di Parent Project, per fornire informazioni sulle attività e sulla mission dell’associazione.
Per informazioni e prenotazioni:
Irene Del Vecchio – tel. 06/66182811 – i.delvecchio@parentproject.it
Distrofia di Duchenne: CRISPR affila le forbici
Condividiamo con piacere l'articolo "Distrofia di Duchenne: CRISPR affila le forbici" della giornalista e divulgatrice scientifica Anna Meldolesi, che riporta alcuni degli aggiornamenti forniti in occasione della XVII Conferenza Internazionale di Parent Project in tema di editing genomico.
L'articolo è stato pubblicato sul blog CRISPeR mania e sulla rivista Le Scienze.
Link all'articolo sul blog:
https://crispr.blog/2019/02/21/distrofia-di-duchenne-crispr-affila-le-forbici/
Link all'articolo su Le Scienze:
http://www.lescienze.it/news/2019/02/22/news/distrofia_di_duchenne_crispr_affila_le_forbici-4305592/
Reclutamento Studio Clinico ESSENCE Per Il Registro Pazienti
Il Registro Pazienti DMD/BMD Italia ha concluso in questi giorni l’elaborazione di una richiesta finalizzata al reclutamento (da poco riaperto in Italia) dei pazienti DMD potenzialmente eleggibili per la partecipazione al trial clinico ESSENCE di fase 3 per valutare l’efficacia e la sicurezza di casimersen e golodirsen, precedentemente noti come SRP-4045 e SRP-4053, in bambini con distrofia muscolare di Duchenne.
L’obiettivo dello studio è valutare l’efficacia di SRP-4045 e SRP-4053 rispetto al placebo in pazienti affetti da DMD con mutazione rispettivamente trattabile con lo skipping dell’esone 45 e dell’esone 53. Lo studio valuterà inoltre la sicurezza, la tollerabilità e la farmacocinetica di SRP-4045 e SRP-4053.
Lo studio, finanziato da Sarepta Therapeutics, è in doppio cieco e controllato con il placebo. Durante il trial i pazienti saranno assegnati casualmente al gruppo che riceverà la molecola sperimentale (SRP-4045 30mg/kg o SRP-4053 30mg/kg) o il placebo attraverso infusioni intravenose una volta a settimana per un periodo complessivo di 96 settimane. Al termine dello studio, seguirà un periodo di estensione in aperto in cui tutti i pazienti riceveranno il trattamento sperimentale per un periodo di 48 settimane.
Lo studio arruolerà circa 222 pazienti dei quali, almeno 111, trattabili con lo skipping dell’esone 45 e 111 trattabili con lo skipping dell’esone 53. Di questi 222 pazienti, circa 148 riceveranno il trattamento con SRP-4045 o SRP-4053 (a seconda della mutazione) e 74 riceveranno il placebo.
L’ufficio scientifico di Parent Project onlus, che si occupa parallelamente anche della gestione del Registro Pazienti, un importante strumento d’informazione al servizio della comunità, ha individuato e informato 10 pazienti in possesso delle caratteristiche minime indicate dai criteri d’inclusione qui di seguito indicati:
-
bambini con diagnosi di distrofia muscolare di Duchenne confermata geneticamente con una delezione nel gene della distrofina che possa essere corretta attraverso:
- skipping dell’esone 45 ovvero delezione degli esoni 7-44, 12-44, 18-44, 44, 46, 46-47, 46-48, 46-49 46-51, 46-53, 46-55, 46-57, 46-59, 46-60, 46-67, 46-69, 46-75 e 46-78
- skipping dell’esone 53 ovvero delezione degli esoni 3-52, 4-52 5-52, 6-52, 9-52, 10-52, 11-52, 13-52, 14-52, 15-52, 16-52, 17-52, 19-52, 21-52, 23-52, 24-52, 25-52, 26-52, 27-52, 28-52, 29-52, 30-52, 31-52, 32-52, 33-52, 34-52, 35-52, 36-52, 37-52, 38-52, 39-52, 40-52, 41-52, 42-52, 43-52, 45-52, 47-52, 48-52, 49-52, 50-52, 52, 54-58, 54-61, 54-63, 54-64, 54-66, 54-76, 54-77;
- bambini di età compresa tra 7 e 13 anni;
- bambini deambulanti;
- bambini in trattamento stabile con steroidi da almeno 6 mesi;
- bambini che non sono coinvolti in studi clinici con molecole sperimentali da almeno 6 mesi.
In Italia il trial clinico coinvolge 4 centri clinici:
- Policlinico Universitario Agostino Gemelli di Roma (Sperimentatore principale: Eugenio Mercuri)
- Istituto Giannina Gaslini di Genova (Sperimentatore principale: Claudio Bruno)
- Università degli Studi di Ferrara (Sperimentatore principale: Alessandra Ferlini)
- Policlinico Universitario G. Martino di Messina (Sperimentatore principale: Giuseppe Vita)
Vi ricordiamo che la selezione finale dei pazienti pienamente idonei a partecipare a questo studio sarà a cura dei responsabili dei centri clinici sopra indicati che dovranno valutare ulteriori parametri clinici e biologici per definire i pazienti arruolabili.
Per maggiori informazioni sul trial, potete:
- consultare la scheda nella brochure dei trial 2019 al seguente link
- visitare il sito http://clinicaltrials.gov/ct2/show/NCT02500381
- contattare l’ufficio scientifico di Parent Project onlus attraverso il numero verde 800 943 333 o scrivendo alla mail del registro: informa@registrodmd.it