![]() Terapia genica ed
Terapia genica ed  Exon skipping
Exon skipping
Continuiamo con il resoconto del convegno “I trial clinici e la ricerca Duchenne e Becker nel mondo” dello scorso febbraio a MIlano. Questa parte è dedicata alla terapia genica ed in particolar modo all’exon skipping.
Nell’ottica di una terapia genica per la DMD, l’ostacolo più importanteè rappresentato dalle enormi dimensioni del  gene della
gene della  Distrofina: 2.4Mb, il più grande gene contenuto nel nostro
Distrofina: 2.4Mb, il più grande gene contenuto nel nostro  DNA. Ciò fa si che la normale sostituzione genica non si presenti come un approccio facile,ed è per questo che nel corso degli anni sono state studiate tutta un aserie di strategie alternative. Dalla creazione di vettori adatti al trasporto dell’intero gene della distrofina, alla creazione di geni sostitutivi più corti(minidistrofina), all’approccio dell’exon skipping.
DNA. Ciò fa si che la normale sostituzione genica non si presenti come un approccio facile,ed è per questo che nel corso degli anni sono state studiate tutta un aserie di strategie alternative. Dalla creazione di vettori adatti al trasporto dell’intero gene della distrofina, alla creazione di geni sostitutivi più corti(minidistrofina), all’approccio dell’exon skipping.
Alcuni di questestrategie sono state presentate da ricercatori venuti da diversi angoli del mondo.
Terapia genica con vettori  AAV
AAV
 Annick Martin
Annick Martin
Con la sua presentazione, Annick Martindell’Associazione Francese contro le Miopatie (AFM), associazione creata nel 1958 da un gruppo di famiglie di pazienti per sostenere lo sviluppo di nuovi strumenti scientifici per lo studio di malattie genetiche rare, ha illustrato alcuni progetti di ricerca in corso che si basano sull’utilizzo diVirus Adeno-Associati (AAV) come “mezzo” per veicolare geni nelle cellule.
Questi vettori hanno il vantaggio di avere una buona efficienza di trasferimento nelle cellule muscolari e cardiache, mantenendo unarisposta immunitaria ridotta. Inoltre non c’è integrazione del gene introdotto nel DNA delle cellule ospite, e ciò elimina la possibilità di insorgenza tumorale. Per di più l’espressione del gene introdotto viene mantenuta per anni, in maniera stabile, nelle cellule trattate. Negli ultimi anni, gli AAV sono stati i vettori scelti per la maggior parte delle sperimentazioni cliniche. Ad oggi, nel mondo, sono in corso ben 28 trial clinici con AAV con dati positivi circa la loro efficacia.
Un limite dei vettori AAV è però la loro dimensione, sono piuttosto piccoli e non possono veicolare materiale genetico superiore alle 5mila basi di lunghezza. La parte codificante del gene della distrofina che con i suoi 79 esoni è lunga circa 14mila basi deve essere quindi accorciata per poter essere inserita in un AAV. Negli ultimi anni sono stati ideati studi con l’utilizzo di una forma più corta del gene della distrofina, chiamata minidistrofina, “costruita” in maniera tale che le regioni fondamentali per il funzionamento della proteina vengano mantenute. Un approccio che non prevede una vera e propria cura, piuttosto una conversione della distrofia muscolare di Duchenne nella forma più lieve di tipo Becker.
Ad oggi sono in corso diversi studi basati sul sistema AAV-minidistrofina, tra cui quello portato avanti dalla biotech Askbio che ha avviato una sperimentazione clinica su di una forma corta di distrofina chiamata Biostrophin. Per il momento lo studio sta valutando la sicurezza dell’approccio terapeutico mediante la somministrazione intramuscolare in sei ragazzi DMD.
Un altro filone, molto promettente, è l’utilizzo di AAV per veicolare all’interno delle cellule muscolari un gene terapeutico. Questo gene (parliamo di geni diversi a seconda del gruppo di ricerca) codifica per molecole di RNA disegnate ad hoc per effettuare l’exon skipping. Su questa ricerca sono impegnati un gruppo francese ed un gruppo italiano (vedere più avanti).
Altri approcci di terapia genica, in fase ancora molto preliminare, sono invece basati sulla modulazione del gene per l’utrofina o la somministrazione di agenti anti-miostatina.
L’exon skipping
L’exon skipping (letteralmente tradotto come “salto dell’esone”) è una tecnica che mira ad eliminare il “danno molecolare” modificando direttamente l’RNA messaggero che codifica per la distrofina.
La terapia basata sull’exon skipping non può essere considerata una cura vera e propria, piuttosto un modo per convertire la distrofia di Duchenne in quella di tipo Becker, ovvero un modo per ridurre la gravità della distrofia. Quando una mutazione cambia lo schema di lettura del gene della distrofina, chiamato in gergo “reading frame”, non vi è più la produzione della proteina funzionale e ciò causa l’insorgenza della DMD. Il corretto schema di lettura del gene può essere ristabilito eliminando direttamente uno o più esoni corrispondenti alla regione in cui è presente la mutazione.
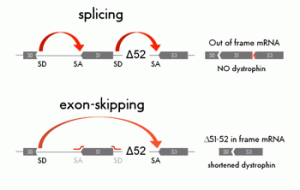 Questo processo di eliminazione viene effettuato usando dei corti frammenti di RNA, chiamati antisenso, che si appaiano in zone specifiche dell’RNA messaggero (in particolare alle giunzioni di splicing degli esoni). Alla fine di questa “operazione molecolare”, la distrofina prodotta sarà più corta del normale ma, se il pezzo eliminato non corrisponde ad una regione cruciale, la proteina potrà ancora svolgere la sua funzione muscolare. La versione corta presenta dei difetti, ma una distrofina meno funzionale è pur sempre meglio rispetto alla quasi completa assenza. Insomma, il concetto è di limitare i danni agendo direttamente sulla causa.
Questo processo di eliminazione viene effettuato usando dei corti frammenti di RNA, chiamati antisenso, che si appaiano in zone specifiche dell’RNA messaggero (in particolare alle giunzioni di splicing degli esoni). Alla fine di questa “operazione molecolare”, la distrofina prodotta sarà più corta del normale ma, se il pezzo eliminato non corrisponde ad una regione cruciale, la proteina potrà ancora svolgere la sua funzione muscolare. La versione corta presenta dei difetti, ma una distrofina meno funzionale è pur sempre meglio rispetto alla quasi completa assenza. Insomma, il concetto è di limitare i danni agendo direttamente sulla causa.L’exon skipping rappresenta una delle tecniche più promettenti del momento e su di essa si stanno impegnando diversi gruppi di ricerca nel mondo. Da una parte vi è l’exon skipping mediato da semplici molecole di RNA (l’approccio farmacologico), e dall’altra l’exon skipping effettuato mediante tecniche di terapia genica. Negli ultimi due anni si è sentito molto parlare dell’avvio di trial clinici con
 AON (
AON ( Oligonucleotidi antisenso), ovvero molecole di RNA sintetizzate in laboratorio, su cui stanno puntando Prosensa, un’azienda biotech olandese, e MDEX, un consorzio britannico. L’altro filone di ricerca, portato avanti da un gruppo italiano ed uno francese, si basa invece sull’utilizzo di AAV (Virus Adeno-Associati) per veicolare i “geni terapeutici” che codificano per l’RNA necessario all’exon skipping. Gli studi sono prevalentemente focalizzati sull’eliminazione dell’esone 51, questo perche’ il salto di questo esone permette di agire sull’effetto delle
Oligonucleotidi antisenso), ovvero molecole di RNA sintetizzate in laboratorio, su cui stanno puntando Prosensa, un’azienda biotech olandese, e MDEX, un consorzio britannico. L’altro filone di ricerca, portato avanti da un gruppo italiano ed uno francese, si basa invece sull’utilizzo di AAV (Virus Adeno-Associati) per veicolare i “geni terapeutici” che codificano per l’RNA necessario all’exon skipping. Gli studi sono prevalentemente focalizzati sull’eliminazione dell’esone 51, questo perche’ il salto di questo esone permette di agire sull’effetto delle  Delezione degli esoni 48, 49 e 50 che sono le piu’ frequenti.
Delezione degli esoni 48, 49 e 50 che sono le piu’ frequenti.Gli AON in uso in questo momento sono di due tipi: da una parte ci sono i2-O-methyl AON, sperimentati dagli olandesi, e dall’altra parta i
 Morpholino, sperimentati dagli inglesi e dagli australiani. Entrambi gli AON sono oligonucleotidi chimicamente modificati, ciò li rende più stabili e non vengono distrutti all’interno delle cellule muscolari. Alcuni aspetti legati all’efficacia di azione in determinate condizioni li differenzia ma i due approcci sembrano, al momento, essere entrambi promettenti.
Morpholino, sperimentati dagli inglesi e dagli australiani. Entrambi gli AON sono oligonucleotidi chimicamente modificati, ciò li rende più stabili e non vengono distrutti all’interno delle cellule muscolari. Alcuni aspetti legati all’efficacia di azione in determinate condizioni li differenzia ma i due approcci sembrano, al momento, essere entrambi promettenti.1- Gli AON olandesi
 Annemieke Aartsma-Rus
Annemieke Aartsma-RusProsensa è una company biotech olandese creata 5 anni fa da ricercatori universitari. Gli olandesi hanno il merito di aver avviato, nel 2006, il primo studio clinico basato sull’uso di AON su pazienti DMD. Alla conferenzaAnnemieke Aartsma-Rus, dell’Università di Leiden in Olanda, ha presentato lo stato dell’arte della tecnica e i risultati sulle sperimentazioni cliniche concluse ed in corso.
Le prime sperimentazioni di fase II sono state effettuate su 4 ragazzi DMD, di età compresa tra gli 8 ed i 16 anni, con singole iniezioni di un 2-O-methyl AON (PRO 051) contro l’esone 51 nel muscolo tibiale anteriore. I risultati sono davvero incoraggianti: analisi molecolari e istologiche su biopsie del muscolo hanno mostrato una produzione di nuova distrofina ad un mese dall’iniezione. Lo scopo del primo studio è stato di provare che l’exon skipping dell’esone 51 funzioni per diversi tipi di mutazioni, infatti i ragazzi reclutati presentano delezioni su diversi esoni adiacenti al 51. Si puo’ dire quindi che l’ipotesi formulata funziona.
Ora il team olandese ha avviato una nuova sperimentazione: la somministrazione degli AON per
 via sistemica. Questa seconda via permetterebbe agli AON di raggiungere i vari distretti del corpo ed agire così su tutti i muscoli colpiti dalla distrofia. Diversi oligonucleotidi sono già stati testati, e messi a punto, con esperimenti condotti su topi e scimmie. Dai risultati preliminari i ricercatori hanno deciso di focalizzare il trial clinico su 2 diversi AON, uno contro l’esone 51 e l’altro contro l’esone 46. E’ previsto che lo studio sia condotto in Europa e negli Stati Uniti, su un numero compreso tra i 15 e i 20 pazienti DMD. Questi verranno trattati con una iniezione settimanale per 5 settimane di seguito e, oltre alle analisi molecolari sulla distrofina, verranno analizzate la forza e la funzionalità muscolare dei ragazzi.
via sistemica. Questa seconda via permetterebbe agli AON di raggiungere i vari distretti del corpo ed agire così su tutti i muscoli colpiti dalla distrofia. Diversi oligonucleotidi sono già stati testati, e messi a punto, con esperimenti condotti su topi e scimmie. Dai risultati preliminari i ricercatori hanno deciso di focalizzare il trial clinico su 2 diversi AON, uno contro l’esone 51 e l’altro contro l’esone 46. E’ previsto che lo studio sia condotto in Europa e negli Stati Uniti, su un numero compreso tra i 15 e i 20 pazienti DMD. Questi verranno trattati con una iniezione settimanale per 5 settimane di seguito e, oltre alle analisi molecolari sulla distrofina, verranno analizzate la forza e la funzionalità muscolare dei ragazzi.2- I morpholino inglesi
Dopo gli olandesi è stata la volta degli inglesi: il 22 ottobre 2007 il consorzio MDEX ha avuto l’approvazione da parte delle autorità britanniche di iniziare un trial clinico di exon skipping, su pazienti DMD, basato sull’uso di morpholino.
Il trial clinico, avviato sul primo ragazzo lo scorso dicembre, sara’ effettuato su 9 ragazzi DMD di età compresa tra i 13 e i 17 anni. I pazienti saranno divisi in 3 gruppi per la somministrazione di 3 dosi diverse di morpholino, le dosi verranno iniettato localmente in un piccolo muscolo del piede (extensor digitorum brevis) mediante un’unica somministrazione. Le analisi molecolari e istologiche su biopsie di muscolo saranno effettuate dopo 21 giorni dal trattamento. E’ stato scelto il muscolo del piede perché non è, in alcun modo, un muscolo essenziale e si può facilmente rimuovere in caso di eventuali effetti secondari nocivi.
Se i primi risultati saranno positivi, gli inglesi sono intenzionati ad iniziare, il piu’ velocemente possibile, una seconda fase della sperimentazione con la somministrazione sistemica del morpholino. Lo scopo di questo successivo studio sarà, come per gli olandesi, far arrivare la “molecola terapeutica” in tutti i muscoli del corpo.
3- AON per tutti
 Steve Wilton
Steve WiltonSteve Wilton, professore all’University of Western Australia, è uno dei pionieri dell’exon skipping, la sua idea di utilizzare questa metodologia per studiare i meccanismi molecolari sulla distrofina risale al 1996. Nel corso degli anni il ricercatore australiano ha studiato diverse strategie e messo a punto diversi AON (sia 2-O-methyl che morpholino) per una possibile terapia contro la DMD.
Il gruppo di ricerca guidato da Wilton ha effettuato uno screening di AONsu circa cinquecento 2-O-methyl oligonucleotidi disegnati per tutti gli esoni della distrofina, con risultati molto interessanti. “Sono felice di poter affermare che nel mio laboratorio siamo oramai in grado di effettuare l’exon skipping di ogni esone presente nel gene della distrofina – ha dichiarato Wilton – più precisamente dall’esone 2 all’esone 78, visto che il primo e l’ultimo esone sono essenziali e non eliminabili”. Gli esperimenti, pubblicati a febbraio 2007 su Molecular Therapy, sono stati effettuati in colture di cellule muscolari: tutti e 77 gli esoni bersaglio sono stati eliminati con successo. L’efficienza tuttavia non è la stessa per tutti gli AON testati, alcuni funzionano meglio, questo avviene perché certi esoni sono più facilmente rimovibili di altri per i quali, ad esempio, è necessario utilizzare un “cocktail” di diversi AON.
In questi ultimi mesi, i ricercatori stanno mettendo a punto nuove strategie per rendere più efficiente l’exon skipping di questi esoni “refrattari”. Lo scopo è quello di ottenere un certo numero di oligo, che siano buoni candidati per ogni tipo di esone, mediante i quali avviare nuove sperimentazioni sui
 modelli animali e, il prima possibile, sui pazienti.
modelli animali e, il prima possibile, sui pazienti.4- L’exon skipping italiano
 Fernanda De Angelis
Fernanda De AngelisI primi importanti risultati del gruppo di Irene Bozzoni,pubblicati nel 2002 sulla rivista scientifica PNAS (Proceeding of the National Academy of Sciences), sono stati ottenuti su colture di cellule muscolari (i
 mioblasti) di un paziente DMD con una delezione degli esoni 48, 49 e 50. In questo studio sono stati iniettati nei mioblasti alcuni vettori retroviralicontenenti “geni terapeutici” codificanti RNA antisenso in grado di riconoscere le giunzioni di splicing specifiche per eliminare l’esone 51. Con questa strategia è stato dimostrato, prima di tutto, che le molecole di RNA prodotte nelle cellule sono stabili e la loro azione è continuativa nel tempo e, successivamente, che si ha il ripristino della produzione di distrofina, che anche se più corta, è funzionante.
mioblasti) di un paziente DMD con una delezione degli esoni 48, 49 e 50. In questo studio sono stati iniettati nei mioblasti alcuni vettori retroviralicontenenti “geni terapeutici” codificanti RNA antisenso in grado di riconoscere le giunzioni di splicing specifiche per eliminare l’esone 51. Con questa strategia è stato dimostrato, prima di tutto, che le molecole di RNA prodotte nelle cellule sono stabili e la loro azione è continuativa nel tempo e, successivamente, che si ha il ripristino della produzione di distrofina, che anche se più corta, è funzionante.Vista l’efficacia della strategia messa a punto, lo studio è stato esteso al modello animale per la DMD: il topo
 mdx. Questo topo ha una mutazione puntiforme “non senso”, ovvero la formazione di un codone di stop, nell’esone 23 del gene per la distrofina, con la conseguente produzione di una distrofina non funzionale. In questo caso come “navetta” di trasporto per i geni terapeutici sono stati utilizzati AAV. Al convegno Fernanda De Angelis, ricercatrice presso il gruppo di Irene Bozzoni, ha presentato i dati sperimentali dello stusio. La somministrazione locale (per via intramuscolare) o in tutto il corpo (pervia sistemica, mediante la vena nella coda del topo) ha dato risultati molto positivi che sono stati pubblicati su PNAS nel 2006. Le analisi molecolari hanno dimostrato la presenza di alti livelli di RNA antisenso nei muscoli del topo, i quali hanno indotto l’exon skipping dell’esone 23 determinando la produzione di distrofina e, soprattutto, il recupero della funzionalità muscolare. L’introduzione di virus AAV per via sistemica ha permesso di ottenere un’efficiente trasporto degli RNA in tutti i distretti muscolari, inclusi il cuore e il diaframma che rappresentano i tessuti più importanti per il trattamento terapeutico dei malati DMD.
mdx. Questo topo ha una mutazione puntiforme “non senso”, ovvero la formazione di un codone di stop, nell’esone 23 del gene per la distrofina, con la conseguente produzione di una distrofina non funzionale. In questo caso come “navetta” di trasporto per i geni terapeutici sono stati utilizzati AAV. Al convegno Fernanda De Angelis, ricercatrice presso il gruppo di Irene Bozzoni, ha presentato i dati sperimentali dello stusio. La somministrazione locale (per via intramuscolare) o in tutto il corpo (pervia sistemica, mediante la vena nella coda del topo) ha dato risultati molto positivi che sono stati pubblicati su PNAS nel 2006. Le analisi molecolari hanno dimostrato la presenza di alti livelli di RNA antisenso nei muscoli del topo, i quali hanno indotto l’exon skipping dell’esone 23 determinando la produzione di distrofina e, soprattutto, il recupero della funzionalità muscolare. L’introduzione di virus AAV per via sistemica ha permesso di ottenere un’efficiente trasporto degli RNA in tutti i distretti muscolari, inclusi il cuore e il diaframma che rappresentano i tessuti più importanti per il trattamento terapeutico dei malati DMD.Successivi esperimenti effettuati sui topi mdx hanno mostrato l’effetto a lungo termine degli RNA antisenso: 18 mesi dopo l’iniezione sistemica l’RNA antisenso continua ad essere espresso e ad indurre sintesi di distrofina in tutti i distretti muscolari inclusi il cuore e il diaframma. La prolungata espressione di distrofina e i livelli di proteina prodotti sono inoltre tali da preservare questi muscoli dalla forte degenerazione tipica dei topi mdx della stessa eta’ e da migliorarne le capacità funzionali.
Altri tipi di esperimenti di terapia genica hanno dimostrato che, nelle scimmie, i geni veicolati mediante AAV rimangono stabili e attivi per oltre 6 anni.
La strategia di exon skipping mediante l’utilizzo di AAV è quindi assai promettente ai fini di una possibile terapia genica della DMD nell’uomo. L’aspetto più entusiasmante di questa tecnica è proprio l’efficacia a lungo termine. A differenza degli approcci terapeutici di exon skipping basati sugli AON, per i quali la somministrazione delle molecole antisenso avviene quotidianamente per tutto il periodo di trattamento, la strategia italiana lascia sperare per una possibile terapia basata su di un trattamento che viene ripetuto solo ogni 5-6 anni.
Adesso, il percorso per accedere alla sperimentazione sull’uomo prevede ulteriori fasi di sperimentazione pre-clinica per ottimizzare l’efficacia dei vettori virali e delle molecole da utilizzare per ottenere lo skipping di diversi esoni della distrofina, e per verificare la tossicità di questo trattamento. In particolare, il gruppo italiano sta ora testando diverse molecole di RNA antisenso per lo skipping dell’esone 51 e analizzando la possibilita’ di ideare nuove molecole per lo skipping di esoni diversi, l’obiettivo finale e’ di progettare una terapia che possa essere utilizzata per diversi profili genetici e quindi per un numero maggiore di pazienti DMD.
5- L’exon skipping francese
 Olivier Danos
Olivier Danos Alla sana competizione “il miglior exon skipping” partecipa anche un gruppo di ricerca francese, che da anni utilizza vettori AAV per veicolare all’interno delle cellule muscolari geni terapeutici. Olivier Danos, dell’Inserm di Parigi, ha mostrato come esperimenti preliminari dimostrano che l’iniezione nella vena femorale di AAV veicolante il gene U7snRNA porta alla produzione di una forma corta, ma funzionale, della distrofina in gran parte dei muscoli dell’arto trattato. Purtroppo l’approccio mediante AAV pone il problema della risposta immunitaria, un ostacolo che subentra nel caso di iniezioni ripetute del vettore. Il virus ha un involucro proteico che può scatenare una difesa da parte dell’organismo che lo riceve. Per la prima somministrazione non dovrebbero esserci problemi, il sistema immunitario infatti non è ancora fornito degli anticorpi necessari, ma per le somministrazioni successive – quando l’organismo e’ oramai istruito a reagire contro il corpo virale estraneo – necessitano dei trattamenti di immuno-soppressione del paziente.
Benché per gli AAV la risposta immunitaria sia inferiore rispetto a quella generata da altri vettori virali usati in passato, il problema va comunque affrontato e risolto. Su questo si e’ basato l’ultimo lavoro di Olivier Danos, del gruppo di ricerca di Luis Garcia, pubblicato a gennaio su Molecular Therapy. Lo studio, effettuato su topi mdx, ha valutato la possibilità di inoculare il vettore AAV1 mediante ripetute iniezioni intramuscolari. I dati hanno dimostrato che l’introduzione del vettore virale nell’organismo scatena una risposta immunitaria che preclude la possibilità di ri-somministrare il vettore oltre 3 giorni dopo la prima iniezione. Quello che è stato scoperto dai ricercatori è che questa risposta dipende unicamente dalla produzione di anticorpi specifici contro AAV1.
Strategie messe a punto per bloccare i segnali cellulari che stimolano il riconoscimento degli anticorpi virali e l’innesco di una risposta immunitaria hanno dato dei risultati molto incoraggianti. Questi esperimenti rappresentano un punto di partenza per la messa a punto di protocolli di immuno-modulazione, ovvero di sistemi che tengano a bada il sistema immunitario, per permettere una sicura applicazione della terapia genica basata su AAV in pazienti DMD.
di Francesca Ceradini
