Biorepository di cellule staminali derivate da urine: applicazioni in diagnostica e ricerca
Titolare del progetto: Università di Ferrara – Dott.ssa M.S. Falzarano – Prof.ssa A. Ferlini
Durata: 2 anni
Importo: 120.000 euro
Progetto finanziato da Parent Project aps
Finanziato da Parent Project aps, il progetto coordinato da Alessandra Ferlini è dedicato alla creazione e al mantenimento di una biorepository di cellule staminali isolate da campioni di urina (USCs) provenienti da pazienti con distrofia muscolare di Duchenne e Becker (DMD/BMD). Le cellule isolate potranno essere usate come modello di malattia in vitro, per lo screening di farmaci, per la terapia cellulare e per la medicina rigenerativa.
Le cellule staminali isolate da campioni di urina (USCs, Urine-Derived Stem Cells) sono considerate un promettente modello cellulare ottenuto in modo non invasivo, utilizzabile come modello alternativo alle comuni procedure quali la biopsia cutanea e muscolare, necessarie per ottenere colture cellulari per fini diagnostici e di ricerca. In un precedente lavoro, il nostro gruppo di ricerca ha dimostrato che sia le USCs native che le USCs trasformate in cellule muscolari,derivate da un paziente con distrofia muscolare di Duchenne (DMD), riproducono le caratteristiche genetiche della DMD.
Il progetto è dedicato alla creazione e al mantenimento di una biorepository di USCs, con lo scopo di conservare le cellule staminali urinarie.
Le USCs vengono isolate da campioni di urina raccolti e immediatamente processati nel nostro centro clinico o raccolti in differenti centri, conservati per 24 ore e inviati al nostro istituto per essere processati. L’isolamento delle USCs richiede generalmente 2-3 settimane di tempo.
Attualmente, il nostro biorepository è composto da 46 linee cellulari, delle quali 8 provenienti da donatori sani, 4 da pazienti con distrofia muscolare di Becker, 25 da pazienti con DMD e infine 9 da soggetti affetti da altre patologie neuromuscolari. I risultati dimostrano che l’isolamento di USCs sia da urine fresche che conservate per 24 ore è possibile, sebbene la tempistica di consegna delle urine (addizionate con terreno di coltura) non sia sempre idonea. È in corso la valutazione di altre modalità di raccolta al fine di isolare le USCs, se identificate certamente faciliterebbero la raccolta di campioni e la crescita del biorepository.
Questo tipo di cellule può essere utile per molteplici applicazioni come l’uso diagnostico per l’identificazione di mutazioni su RNA in caso di non disponibilità della biopsia muscolare, come modello in vitro per lo screening di nuove molecole terapeutiche e di farmaci per terapie personalizzate, e come generazione di organoidi (es. muscolo scheletrico) da utilizzare come modello di malattia e per la medicina rigenerativa.
Approfondimento
Primo Report
Iniziato a marzo del 2019, questo progetto è stato realizzato grazie alla collaborazione tra Elisabetta Ferraro (Università di Pisa), Francesca De Santa e Alessio Torcinaro (entrambi del Consiglio Nazionale delle Ricerche CNR). Finanziato da Parent Project aps, il progetto è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento alla ricerca detta Fast Track di importo di 20.000€.
Il progetto di ricerca ha lo scopo di stimolare l’attivazione dei macrofagi infiammatori M2 tramite l’uso di farmaci definiti “modulatori del metabolismo”. Gli M2 oltre a inibire l’infiammazione promuovono la rigenerazione e il rimodellamento del muscolo
Background e razionale
Nella distrofia muscolare di Duchenne (DMD), le fibre muscolari vanno incontro a degenerazione cronica che, nelle fasi inziali della malattia, viene contrastata da meccanismi rigenerativi. Tuttavia, la capacità rigenerativa dei muscoli dei pazienti distrofici si riduce drasticamente nel corso della patologia. Una corretta rigenerazione muscolare richiede la partecipazione di cellule del sistema immunitario definite macrofagi, il cui numero aumenta enormemente nel muscolo danneggiato. In un primo momento intervengono i macrofagi di tipo infiammatorio (tipo M1) per rimuovere le fibre danneggiate, ma il loro ruolo deve essere transitorio per una corretta rigenerazione, per cui il loro numero diminuisce drasticamente nelle fasi successive. I macrofagi infiammatori M1 vengono sostituiti da macrofagi anti-infiammatori (tipo M2) che, oltre a inibire gli M1 e l’infiammazione, promuovono la rigenerazione del muscolo.
Viceversa, nella DMD, il processo rigenerativo viene continuamente messo in moto (a causa della mutazione nel gene per la distrofina) con una presenza quasi costante di macrofagi infiammatori nel muscolo, che risulta deleteria fino a contribuire alla riduzione della capacità rigenerativa muscolare.
L’obiettivo di questo progetto è ridurre l’infiammazione cronica del muscolo scheletrico di topi mdx che rappresentano un modello animale di DMD molto usato.
Poiché i macrofagi di tipo M1 e quelli di tipo M2 sono distinguibili per vari aspetti, tra cui l’uso di vie metaboliche diverse, i ricercatori si sono proposti di stimolare l’attivazione dei macrofagi pro-rigenerativi M2 (e inibendo così gli M1 e l’infiammazione) proprio agendo sul metabolismo tramite l’uso di farmaci definiti “modulatori del metabolismo”.
Rispetto ad altre terapie anti-infiammatorie, questi farmaci potrebbero svolgere 2 ruoli contemporaneamente:
i) ridurre l’infiammazione
ii) promuovere l’attivazione dei macrofagi M2 e quindi potenziare la capacità rigenerativa nel muscolo
Inoltre, questi farmaci che agiscono sul metabolismo potrebbero anche avere un effetto benefico diretto, oltre che sui macrofagi, anche sul metabolismo delle fibre muscolari che, nei pazienti distrofici, è fortemente alterato.
Risultati ottenuti
Per realizzare questo progetto sono stati effettuati studi in vitro su cellule (fase I) e studi sul modello animale di DMD (il topo mdx) (fase II). La fase II è stata interrotta a causa dell’emergenza COVID19 e non è ancora stato possibile completarla. Il gruppo di ricerca, con un’estensione temporale di alcuni mesi, porterà quanto prima a termine il lavoro.
Fase I
Nel corso della fase I sono stati studiati gli effetti di sei farmaci modulatori del metabolismo (Trimetazidina, Mildronato, AICAR, Ranolazina, Coenzima Q10 e Riboflavina) sulla capacità dei macrofagi, di attivarsi in macrofagi pro-rigenerativi di tipo M2. E’ stata inoltre valutata la capacità di questi sei farmaci di inibire l’attivazione dei macrofagi verso la tipologia infiammatoria (tipo M1).
Inoltre al fine di valutare lo stato di attivazione dei macrofagi sono stati determinati i livelli di espressione di alcuni marcatori specifici per la popolazione M1 e alcuni per la M2. Di seguito i risultati ottenuti per ciascuna molecola:
AICAR
E’ stato osservato che due concentrazioni diverse del farmaco AICAR sono in grado di inibire, in vitro, l’attivazione dei macrofagi in senso infiammatorio. Tuttavia, la capacità di AICAR di stimolare la polarizzazione macrofagica di tipo M2 non è chiara poiché, analizzando vari marcatori, sono stati evidenziati effetti contrastanti.
Riboflavina
Il pre-trattamento con riboflavina di macrofagi poi sottoposti a stimoli infiammatori (con il lipopolisaccaride batterico, LPS) riduce l’attivazione in senso pro-infiammatorio (tipo M1). Inoltre, la riboflavina è capace di indurre l’espressione di marcatori di polarizzazione in senso protettivo e rigenerativo (tipo M2).
Coenzima Q10
Il pre-trattamento con coenzima Q di macrofagi poi sottoposti a stimoli infiammatori (LPS) riduce l’espressione di vari marcatori pro-infiammatori indotti dall’LPS, in entrambi i tipi cellulari usati dal gruppo di ricerca. Quindi l’attività metabolica indotta dal coenzima Q attenua lo stato infiammatorio, mentre non ha effetto su un potenziamento dei marcatori M2 di tipo rigenerativo.
Ranolazina
La ranolazina ha un certo effetto sulla riduzione dei macrofagi pro-infiammatori in seguito al co-trattamento con LPS, ma non ha nessun effetto nel promuovere quelli anti-infiammatori e rigenerativi (tipo M2).
Miladronato
Il Mildronato non ha alcun effetto sull’attivazione macrofagica di tipo pro-infiammatorio, ne’ su quella di tipo M2.
Trimetazidina
Gli effetti della trimetazidina sulla polarizzazione macrofagica (tipo M1 e tipo M2) in vitro non sono risultati statisticamente significativi.
Fase II
Grazie agli esperimenti in vitro realizzati durante la fase I sono stati selezionati i tre farmaci più promettenti (AICAR, coenzimaQ10 e riboflavina) per la loro capacità di inibire l’attivazione macrofagica di infiammatorio (tipo I) e/o di stimolare la formazione dei macrofagi pro-rigenerativi di tipo M2. Nel corso della fase II, questi tre farmaci verranno somministrati al modello murino di DMD per valutare la loro capacità di contrastare la malattia.
Prima dell’emergenza COVID-19 sono stati effettuati degli esperimenti pilota della fase II trattando i modelli murini di distrofia (topo mdx) nella fase rigenerativa (13 settimane) con AICAR e riboflavina. Queste molecole sono state somministrate intraperitonealmente per 15 giorni. Ai controlli è stata somministrata soluzione fisiologica.
Sono stati quindi valutati il livello di fibrosi e il danno muscolare. I risultati finora ottenuti sono i seguenti:
- il livello di fibrosi non sembra cambiare in seguito al trattamento con AICAR e riboflavina, nelle condizioni usate
- la dimensione delle fibre muscolari tende ad aumentare (quindi l’atrofia muscolare sembra essere parzialmente contrastata) in seguito al trattamento sia con riboflavina che con AICAR.
- la riboflavina induce un aumento del numero di fibre positive alla miosina embrionale, il che suggerisce un attivo programma rigenerativo anche nelle fasi tardive della malattia
Conclusioni
Questi esperimenti pilota in vivo giustificano un certo ottimismo circa l’uso di questi modulatori del metabolismo nella DMD. Questi dati dovranno essere confermati testando i farmaci selezionati (incluso il coenzima Q10) su un numero maggiore di animali e anche iniziando la somministrazione in fasi più precoci della malattia. Inoltre, l’entità dell’infiltrato infiammatorio e la funzionalità muscolare dovranno essere testati.
E’ importante sottolineare il fatto che alcuni di questi farmaci sono già stati approvati dall’EMA (Agenzia Europea per i Medicinali) per l’uso nell’uomo in altre patologie, il che rende il loro potenziale utilizzo nella DMD molto più rapido rispetto a farmaci nuovi visto che molte fasi della sperimentazione clinica, soprattutto relative alla tossicità nell’essere umano, sono già state realizzate.
Report Finale
Il progetto è iniziato a marzo del 2019 ed è stato realizzato grazie alla collaborazione tra Elisabetta Ferraro, Francesca De Santa e Alessio Torcinaro. Finanziato da Parent Project aps, il progetto è uno dei quattro che ha ricevuto, attraverso il bando per la ricerca 2018, la tipologia di finanziamento alla ricerca detta Fast Track, per l’importo di 20.000€. Dati sempre più numerosi dimostrano che il metabolismo dei macrofagi infiammatori è diverso da quello dei macrofagi pro-rigenerativi e anti-infiammatori. L’obiettivo di questo studio è stato quello di stimolare il metabolismo di tipo mitocondriale tipico dei macrofagi anti-infiammatori al fine di contrastare l’infiammazione del muscolo distrofico e, al contempo, di promuoverne la rigenerazione.
Una corretta rigenerazione muscolare richiede la partecipazione di cellule del sistema immunitario definite macrofagi. Subito dopo un danno muscolare, il muscolo viene colonizzato da numerosi macrofagi pro-infiammatori (tipo M1) che poi vengono sostituiti da macrofagi con effetto anti-infiammatorio e rigenerativo (tipo M2). Viceversa, nella DMD, il danno muscolare è continuo, per cui si ha una presenza costante di macrofagi infiammatori, che risulta deleteria e contribuisce alla riduzione della capacità rigenerativa del muscolo scheletrico.
Le popolazioni macrofagiche di tipo M1 e di tipo M2 utilizzano vie metaboliche diverse per ricavare l’energia necessaria alla loro sopravvivenza. L’idea progettuale è stata quindi quella di stimolare i processi metabolici usati dai macrofagi M2 (metabolismo principalmente mitocondriale) per indurre la maturazione macrofagica verso il tipo M2 e contrastare la maturazione verso il tipo M1 infiammatorio, al fine di ridurre l’infiammazione cronica del muscolo distrofico.
A tal scopo è stato valutato, in vitro, l’effetto anti-infiammatorio di cinque molecole note per agire su vari processi metabolici (riboflavina-5’-fosfato/vitamina B2-fosfato, idebenone, ranolazina, trimetazidina e mildronato), che sono state somministrate a macrofagi murini trattati con uno stimolo pro-infiammatorio, il lipopolisaccaride. È stata valutata l’espressione genica di citochine infiammatorie, quali interleuchina-1beta e interleuchina-6, nonché quella della chemochina CCL2 e di molecole associate prevalentemente al fenotipo rigenerativo, come Arginasi-1 e CD206.
Tra le molecole che hanno indotto in vitro una risposta antiinfiammatoria (riboflavina-5’-fosfato, idebenone e ranolazina), la riboflavina-5’-fosfato e l’idebenone sono state testate in vivo utilizzando il modello murino per la distrofia muscolare di Duchenne (il topo mdx) mediante un trattamento a breve e uno a lungo termine. Il trattamento a breve termine è consistito in un mese di somministrazioni giornaliere (a partire da 2 mesi fino ai 3 mesi di età dei topi), mentre quello a lungo termine è consistito nel trattamento breve addizionato di cicli intermittenti (ogni due mesi) di due settimane di somministrazione fino all’età di 9 mesi.
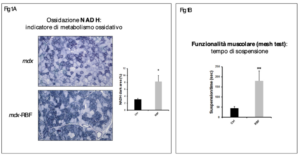
Riboflavina-5’-fosfato (1mg/topo/die; somministrazione intraperitoneale) – In seguito ai trattamenti con riboflavina-5’-fosfato, sia quello breve che quello lungo, il numero di fibre ossidative è aumentato in maniera considerevole (figura 1A) con una riduzione della fibrosi, dell’espressione del collagene e dell’infiltrato infiammatorio. Rispetto al trattamento breve, il trattamento lungo ha mostrato, inoltre, un maggiore e significativo incremento della funzionalità muscolare (figura 1B) e un aumento dei livelli di marcatori anti-infiammatori come Arginasi-1 e CD163. Inoltre, è risultata evidente e statisticamente significativa la riduzione delle fibre necrotiche in seguito al trattamento con riboflavina-5’-fosfato.
Idebenone (1mg/topo/die; somministrazione intraperitoneale) – Nonostante l’idebenone abbia rivelato un potente effetto anti-infiammatorio in vitro su macrofagi umani, il trattamento a breve termine sul modello murino mdx con idebenone non ha mostrato differenze significative dei parametri valutati rispetto agli animali non trattati. Tuttavia, il trattamento a lungo termine con questa molecola ha indotto un incremento del numero di fibre ossidative, anche se in misura minore rispetto alla riboflavina-5’-fosfato, una riduzione della fibrosi e dell’espressione del collagene e, solo nel 50% degli animali, una riduzione delle fibre necrotiche che si traduce in una assenza di riduzione statisticamente significativa delle fibre necrotiche. Infine, anche il trattamento lungo con idebenone, così come quello con riboflavina-5’-fosfato, ha indotto un significativo incremento della funzionalità muscolare.
Rispetto ad altre terapie anti-infiammatorie, l’uso di queste molecole in clinica potrebbe essere vantaggioso per il fatto che esse potrebbero svolgere contemporaneamente due ruoli: i) ridurre l’infiammazione e ii) promuovere la capacità rigenerativa del muscolo. Inoltre, i dati suggeriscono che queste molecole, poiché agiscono sul metabolismo, abbiano un effetto benefico diretto, oltre che sui macrofagi, anche sulle fibre muscolari il cui metabolismo, nei pazienti distrofici, è fortemente alterato.
